Radón
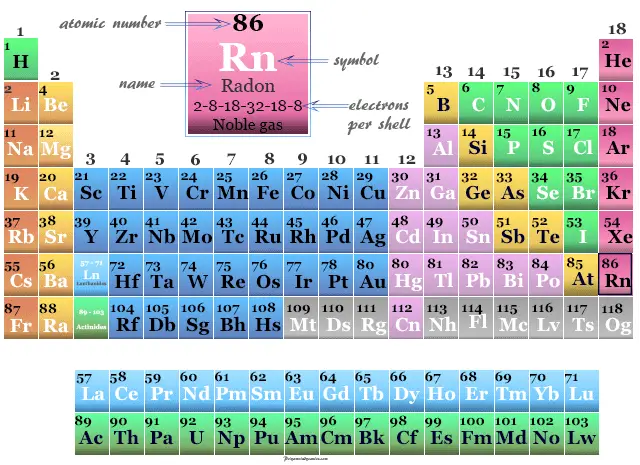
Radón es un elemento químico o gas noble o elemento del Grupo 18 de la tabla periódica con símbolo rn y número atómico 86. Fue descubierto por Ernest Rutherford y Soddy en 1899 a través de la descomposición radiactiva de sustancias.
Es un elemento incoloro, inodoro, insípido y fuertemente radiactivo obtenido a partir del radio-226 por emisión de partículas alfa. La radiactividad o reacción en cadena del uranio y el torio produce naturalmente una pequeña cantidad de radón.
Lectura relacionada: Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso
Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso¿Dónde se encuentra el radón?
Se encuentra en rocas, suelos y gases naturales. El gas radón se libera cuando se queman combustibles fósiles como el coque o el gas natural.
Rn-222 es el isótopo más longevo del elemento con una vida media de 3,8 días. Es un miembro de las tres series radiactivas naturales.
El gas radón se mueve desde varias fuentes hacia el aire, las aguas subterráneas y las aguas superficiales. Llega a nuestra casa a través de la tubería de agua.
Lectura relacionada: Neon, Propiedades, Uso, Conexiones, Hechos
Neon, Propiedades, Uso, Conexiones, HechosRadón en la tabla periódica
Antes de 1960, el helio, el neón, el argón, el criptón, el xenón y el radón se conocían como gases inertes o raros. Ahora se llama gas noble y se ubica en el grupo 18 o en el grupo 0 de la tabla periódica. Este gas era desconocido en la época de Mendeleev.
 Vanadio, Propiedades, Producción, Conexiones, Uso
Vanadio, Propiedades, Producción, Conexiones, UsoCuando fue descubierto y caracterizado, debido a la extrema inercia, el gas se colocó con extrema precisión en la tabla periódica.
Isótopos de radón
El radón-222 es el isótopo radiactivo más longevo del elemento con una vida media de 3,8 días. Debido a la vida útil muy corta, el estudio del elemento es extremadamente difícil.
No tiene isótopos estables, pero formó treinta y nueve isótopos radiactivos con una masa atómica de 193 a 231.
Propiedades del radón
Es incoloro a temperatura ambiente, pero cuando se enfría por debajo del punto de fusión, emite una fosforescencia amarilla brillante. El color cambia a rojo anaranjado cuando se enfría con nitrógeno líquido.
A temperatura ambiente, la densidad y la solubilidad del radón en agua son las más altas de todos los gases nobles como He, Ne, Kr y Xe.
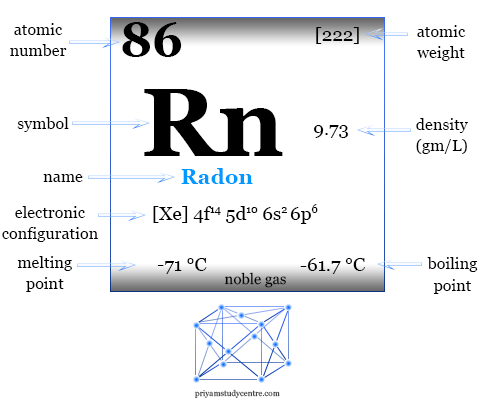
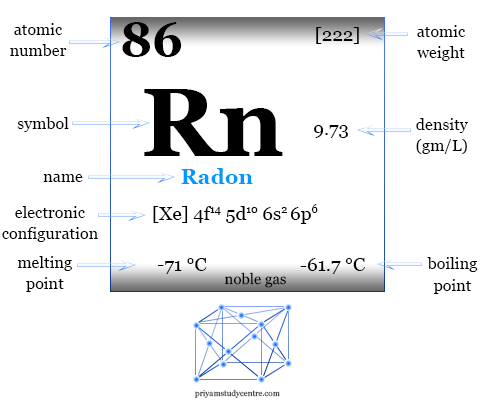
| Radón | |||
| Símbolo | rn | ||
| Descubrimiento | Friedrich Ernst Dorn en 1900 | ||
| Nombre derivado de | A partir del radio, se detectó por primera vez mediante una desintegración radiactiva del radio. | ||
| isótopo común | 211rn, 220rn, 222rn | ||
| Estados de oxidación | 0+2, +6 | ||
| número CAS | 10043-92-2 | ||
| Propiedades periódicas | |||
| número atómico | 86 | ||
| Masa atómica relativa | [222] | ||
| electrón por celda | 2, 8, 18, 32, 18, 8 | ||
| Configuración electrónica | [Xe] 4f14 5d10 6s2 6p6 | ||
| Bloquear | bloque p | ||
| Grupo | 18 | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | Gas | ||
| Punto de fusion | −71°C, −96°F, 202K | ||
| Punto de ebullición | −61,7°C, −79,1°F, 211,5K | ||
| Capacidad calorífica molar | 20.786 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 0,009074 g/cm3 | ||
| Temperatura y presión críticas | 377 K y 6,28 MPa | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.20 | ||
| Radio covalente | 1.46 | ||
| Electronegatividad | desconocido | ||
| Afinidad electronica | desconocido | ||
| Energía de ionización (kJ/mol) | 1037.07 | ||
Propiedades químicas
Al igual que otros gases nobles, también es miembro de elementos de valencia cero que lo hacen químicamente inerte. La energía de ionización del radón es ligeramente inferior a la del xenón. El hecho sugiere que Rn es más reactivo que Xe.
Debido a su corta vida media, el estudio de las propiedades químicas del radón es muy difícil. Se utiliza naturalmente como marcador natural para el análisis químico. Es volátil por encima de -80°C, pero los compuestos no son volátiles en las mismas condiciones.
Proceso de producción
Se produce directamente por la desintegración de la radiación alfa de una solución acuosa de cloruro de radio.
88real academia de bellas artes226 → 86rn222 + 2Él4
El gas se diluye en gran medida por el ozono, el hidrógeno y el oxígeno producidos por la irradiación alfa del agua. La mezcla de gases pasó sobre cobre caliente y óxido de cobre (II) y finalmente se secó con pentóxido de fósforo para obtener radón puro.
Datos sobre el radón
Inspirado por el desarrollo de la química del xenón, tiene sentido formar una rica química del radón a partir de consideraciones energéticas. Pero debido a la vida útil muy corta y la baja disponibilidad del elemento en la atmósfera terrestre, estudiarlo en la ciencia es muy difícil.
Un g de Ra-226 produce solo 1 g de Ra. Por lo tanto, el estudio del elemento se limita a los estudios de trazadores.
Ingredientes químicos
El radón reacciona con flúor gaseoso a temperatura ambiente o flúor líquido a -196 °C, el recipiente de reacción retiene algo de actividad gamma después de bombear el compuesto volátil.
Sugiere que se puede formar un enlace químico iónico en fluoruro iónico como Rn+F o (RnF+)F. La molécula de flúor se reduce con gas hidrógeno a 500 °C para liberar el elemento del compuesto de fluoruro. También es oxidado por varios cationes interhalógenos a Rn. dar+ o RnF+ que puede ser retenido por resina de intercambio iónico.
Se puede realizar una oxidación similar en trifluoruro de cloro líquido (ClF3) o trifluoruro de bromo (BrF3). En la electrólisis, el radón parece moverse a un electrodo o cátodo positivo, lo que sugiere que ha formado especies catiónicas en la electrólisis.
Efectos del radón
- Los cambios en la concentración de radón en las aguas subterráneas son el símbolo para predecir el terremoto en nuestra zona.
- Ocurre en la naturaleza como un gas que afecta la salud humana y causa cáncer de pulmón a través de la formación de radicales libres.
- El radón es un contaminante conocido cuando se emite a partir de fuentes de energía renovables, como las plantas de energía geotérmica, pero ya no afecta el medio ambiente ni la salud humana de nuestra tierra.
Provoca cáncer de pulmón al respirar. Según la Oficina de Contaminación Ambiental de EE. UU., es el segundo material que causa cáncer de pulmón después de fumar cigarrillos.
uso de radón
- Se prepara comercialmente para su uso en radioterapia. Se usa en radioterapia para destruir las células cancerosas que causan cáncer.
- El radón también se utiliza como material de nucleótidos en el reactor de las centrales nucleares.
- La radiación del espectro electromagnético del radón radiactivo se utiliza en la fundición de metales y en las pruebas de radiografía industrial.