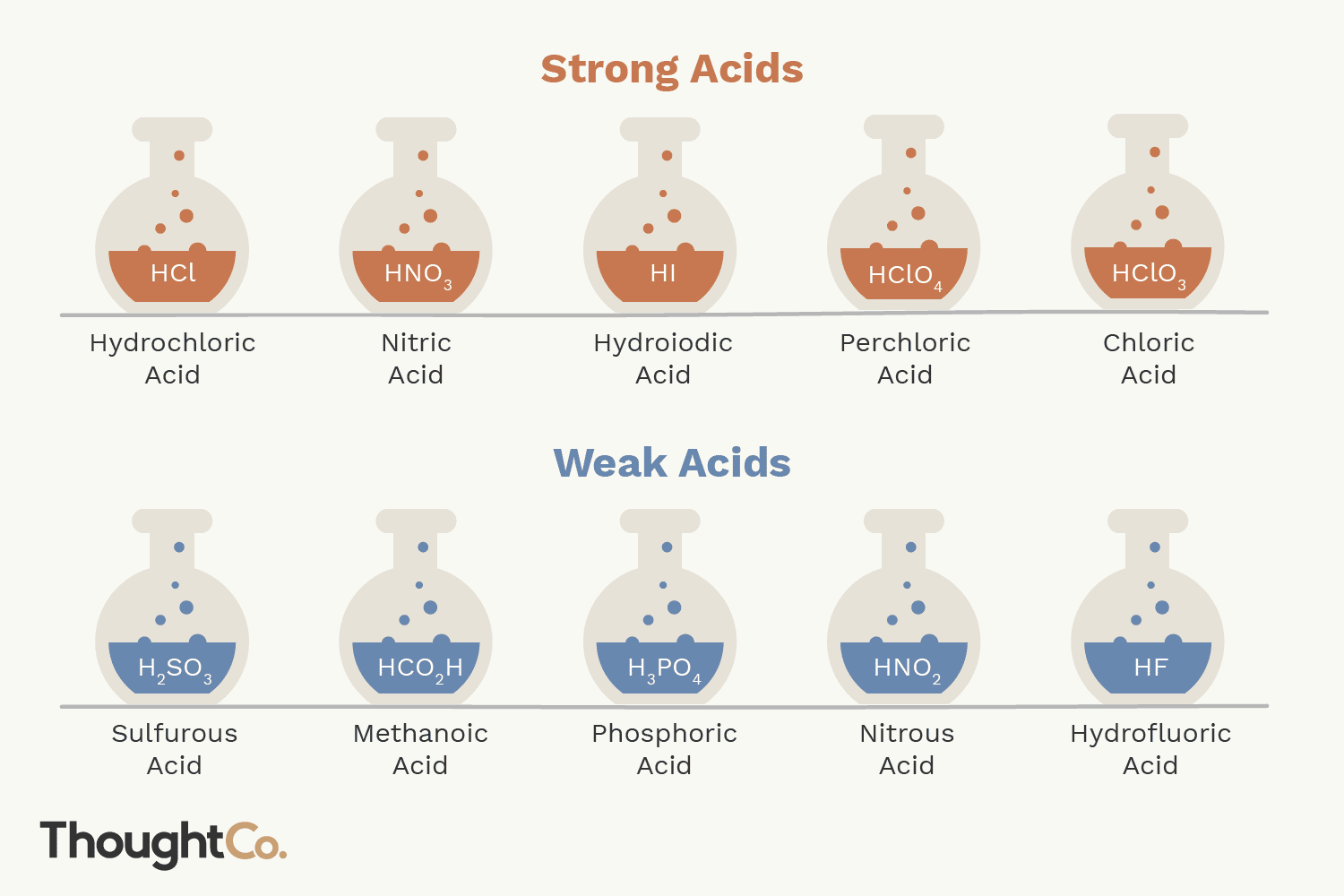
Es importante conocer los ácidos fuertes y débiles tanto para la clase de química como para su uso en el laboratorio. Hay muy pocos ácidos fuertes, por lo que una de las maneras más fáciles de distinguir los ácidos fuertes y débiles es memorizar la lista corta de los fuertes. Cualquier otro ácido se considera un ácido débil.
Conclusiones Clave
- Los ácidos fuertes se disocian completamente en sus iones en el agua, mientras que los ácidos débiles solo se disocian parcialmente.
- Solo hay unos pocos (7) ácidos fuertes, por lo que muchas personas eligen memorizarlos. Todos los demás ácidos son débiles.
- Los ácidos fuertes son ácido clorhídrico, ácido nítrico, ácido sulfúrico, ácido bromhídrico, ácido yodhídrico, ácido perclórico y ácido clórico.
- El único ácido débil formado por la reacción entre hidrógeno y un halógeno es el ácido fluorhídrico (HF). Aunque técnicamente es un ácido débil, el ácido fluorhídrico es extremadamente potente y altamente corrosivo.
Ácidos Fuertes
Los ácidos fuertes se disocian completamente en sus iones en agua, produciendo uno o más protones (cationes de hidrógeno) por molécula. Solo hay 7 ácidos fuertes comunes.
Lectura relacionada: La Composición Elemental del Cuerpo Humano
La Composición Elemental del Cuerpo Humano- HCl-ácido clorhídrico
- HNO3 - ácido nítrico
- H2ENTONCES4 - ácido sulfúrico (HSO4- es un ácido débil)
- HBr-ácido bromhídrico
- Ácido yodhídrico
- HClO4 - ácido perclórico
- HClO3 - ácido clórico
Ejemplos de reacciones de ionización incluyen:
HCl → H+ + Cl-
HNO3 → H+ + NO3-
Lectura relacionada: Aprende A Hacer Cristales Con Estos Sencillos Experimentos
Aprende A Hacer Cristales Con Estos Sencillos Experimentos
H2ENTONCES4 → 2H+ + SO42-
Tenga en cuenta la producción de iones de hidrógeno cargados positivamente y también la flecha de reacción, que solo apunta a la derecha. Todo el reactivo (ácido) se ioniza en producto.
Lectura relacionada:
 Cómo Calcular la Media o Promedio
Cómo Calcular la Media o PromedioÁcidos Débiles
Los ácidos débiles no se disocian completamente en sus iones en el agua. Por ejemplo, el HF se disocia en el H+ y F- iones en agua, pero algo de HF permanece en solución, por lo que no es un ácido fuerte. Hay muchos más ácidos débiles que ácidos fuertes. La mayoría de los ácidos orgánicos son ácidos débiles. Aquí hay una lista parcial, ordenada de más fuerte a más débil.
- HO2C2O2Ácido H-oxálico
- H2ENTONCES3 - ácido sulfuroso
- HSO4 - - ion sulfato de hidrógeno
- H3PO4 - ácido fosfórico
- HNO2 - ácido nitroso
- HF-ácido fluorhídrico
- HCO2Ácido H-metanoico
- C6H5Ácido COOH-benzoico
- CH3Ácido COOH-acético
- Ácido HCOOH-fórmico
Los ácidos débiles se ionizan de forma incompleta. Un ejemplo de reacción es la disociación de ácido etanoico en agua para producir cationes de hidroxonio y aniones etanoato:
CH3COOH + H2O H H3O+ + CH3COO-
Nótese que la flecha de reacción en la ecuación química apunta en ambas direcciones. Solo aproximadamente el 1% del ácido etanoico se convierte en iones, mientras que el resto es ácido etanoico. La reacción procede en ambas direcciones. La reacción inversa es más favorable que la reacción directa, por lo que los iones vuelven a cambiar fácilmente a ácido y agua débiles.
Distinguir Entre Ácidos Fuertes y Débiles
Puedes usar la constante de equilibrio ácido Ka o pKa para determinar si un ácido es fuerte o débil. Los ácidos fuertes tienen alto contenido de Ka o pK pequeñoa valores, los ácidos débiles tienen K muy pequeñoa valores o pK grandesa valores.
Fuerte y Débil Vs. Concentrado y Diluido
Tenga cuidado de no confundir los términos fuerte y débil con concentrado y diluido. Un ácido concentrado es uno que contiene una baja cantidad de agua. En otras palabras, el ácido se concentra. Un ácido diluido es una solución ácida que contiene mucho disolvente. Si tiene ácido acético 12 M, está concentrado, pero sigue siendo un ácido débil. No importa cuánta agua elimines, eso será cierto. Por otro lado, una solución de HCl 0,0005 M está diluida, pero sigue siendo fuerte.
Fuerte Vs. Corrosivo
Puede beber ácido acético diluido (el ácido que se encuentra en el vinagre), pero beber la misma concentración de ácido sulfúrico le provocaría una quemadura química. La razón es que el ácido sulfúrico es altamente corrosivo, mientras que el ácido acético no es tan activo. Si bien los ácidos tienden a ser corrosivos, los superácidos más fuertes (carboranos) en realidad no son corrosivos y podrían sostenerse en la mano. El ácido fluorhídrico, aunque es un ácido débil, pasaría a través de la mano y atacaría los huesos.
Fuentes
- Housecroft, C. E.; Sharpe, A. G. (2004). Química Inorgánica (2ª ed.). Prentice Hall. ISBN 978-0-13-039913-7.
- Porterfield, William W. (1984). Química Inorgánica. Addison-Wesley. ISBN 0-201-05660-7.
- Trummal, Aleksander; Lipping, Lauri; et al. (2016). "Acidez de ácidos fuertes en agua y dimetilsulfóxido". J. Phys. Chem. A. 120 (20): 3663–3669. doi:10.1021/acs.jpca.6b02253