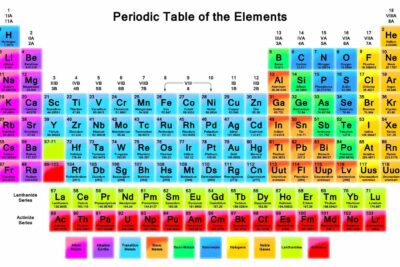
Los halógenos son un grupo de elementos de la tabla periódica conocidos por su reactividad y presencia en diferentes estados de la materia a temperatura ambiente. A menudo, las personas se preguntan "a qué elemento se le denomina halógenos", y la respuesta incluye elementos fundamentales como el flúor, el cloro, el bromo, el yodo y el astato.
La palabra halógeno significa "productor de sal", porque los halógenos reaccionan con los metales para producir muchas sales importantes. De hecho, los halógenos son tan reactivos que no se encuentran como elementos libres en la naturaleza. Sin embargo, son comunes en combinación con otros elementos Aquí hay un vistazo a la identidad de estos elementos, su ubicación en la tabla periódica y sus propiedades comunes.
Lectura relacionada:
 Prefijos de Nomenclatura de Hidrocarburos de Química Orgánica
Prefijos de Nomenclatura de Hidrocarburos de Química OrgánicaUbicación de los Halógenos en la Tabla Periódica
Los halógenos se localizan en el Grupo VIIA de la tabla periódica, o en el grupo 17 usando la nomenclatura IUPAC. Representan una clase particular de no metales y se encuentran hacia el lado derecho de la tabla, en una línea vertical.
Lista de Elementos Halógenos
Cuando se define "a qué elemento se le denomina halógenos", se incluyen los siguientes elementos, que son ampliamente reconocidos en esta categoría:
Lectura relacionada: Definición y Ejemplos de Propiedades Coligativas
Definición y Ejemplos de Propiedades Coligativas- Flúor (F)
- Cloro (Cl)
- Bromo (Br)
- Yodo (I)
- Astato (Ta)
- Elemento 117 (ununseptium, Uus), hasta cierto punto
Aunque el elemento 117 está en el Grupo VIIA, los científicos predicen que puede comportarse más como un metaloide que como un halógeno. Aun así, compartirá algunas propiedades comunes con los otros elementos de su grupo.
Propiedades de los Halógenos
Estos no metales reactivos tienen siete electrones de valencia y muestran propiedades físicas bastante variables. Los estados de la materia de los halógenos varían desde sólidos (I2) a líquido (Br2) a gaseoso (F2 y Cl2) a temperatura ambiente. En su forma pura, estos elementos forman moléculas diatómicas con átomos unidos por enlaces covalentes no polares.
Lectura relacionada: Tipos de Reacciones Químicas (Con Ejemplos)
Tipos de Reacciones Químicas (Con Ejemplos)
En cuanto a las propiedades químicas, los halógenos tienen electronegatividades muy altas, siendo el flúor el elemento con la electronegatividad más alta. Son particularmente reactivos con los metales alcalinos y las tierras alcalinas, formando cristales iónicos estables.
Resumen de Propiedades Comunes
- Electronegatividades muy altas.
- Siete electrones de valencia (uno menos que un octeto estable).
- Alta reactividad, especialmente con metales alcalinos y tierras alcalinas. Los halógenos son los no metales más reactivos.
- Toxicidad que disminuye con halógenos más pesados hasta llegar al astato, que es peligroso debido a su radiactividad.
- El estado de la materia en STP cambia a lo largo del grupo. El flúor y el cloro son gases, el bromo es un líquido y el yodo y el astato son sólidos. Se espera que el elemento 117 también sea un sólido en condiciones normales. El punto de ebullición aumenta al moverse hacia abajo en el grupo debido a la fuerza de Van der Waals.
Usos de los Halógenos
La alta reactividad hace que los halógenos sean excelentes desinfectantes. El blanqueador de cloro y la tintura de yodo son dos ejemplos bien conocidos de usos de estos elementos.
Los compuestos de organobromina, también conocidos como organobromuros, se utilizan como retardantes de llama. Además, los halógenos reaccionan con los metales para formar una variedad de sales esenciales. El ion cloro, obtenido generalmente de la sal de mesa (NaCl), es esencial para la vida humana. El flúor, en forma de fluoruro, se usa para ayudar a prevenir la caries dental. Los halógenos también se emplean en lámparas y en la industria de refrigerantes.