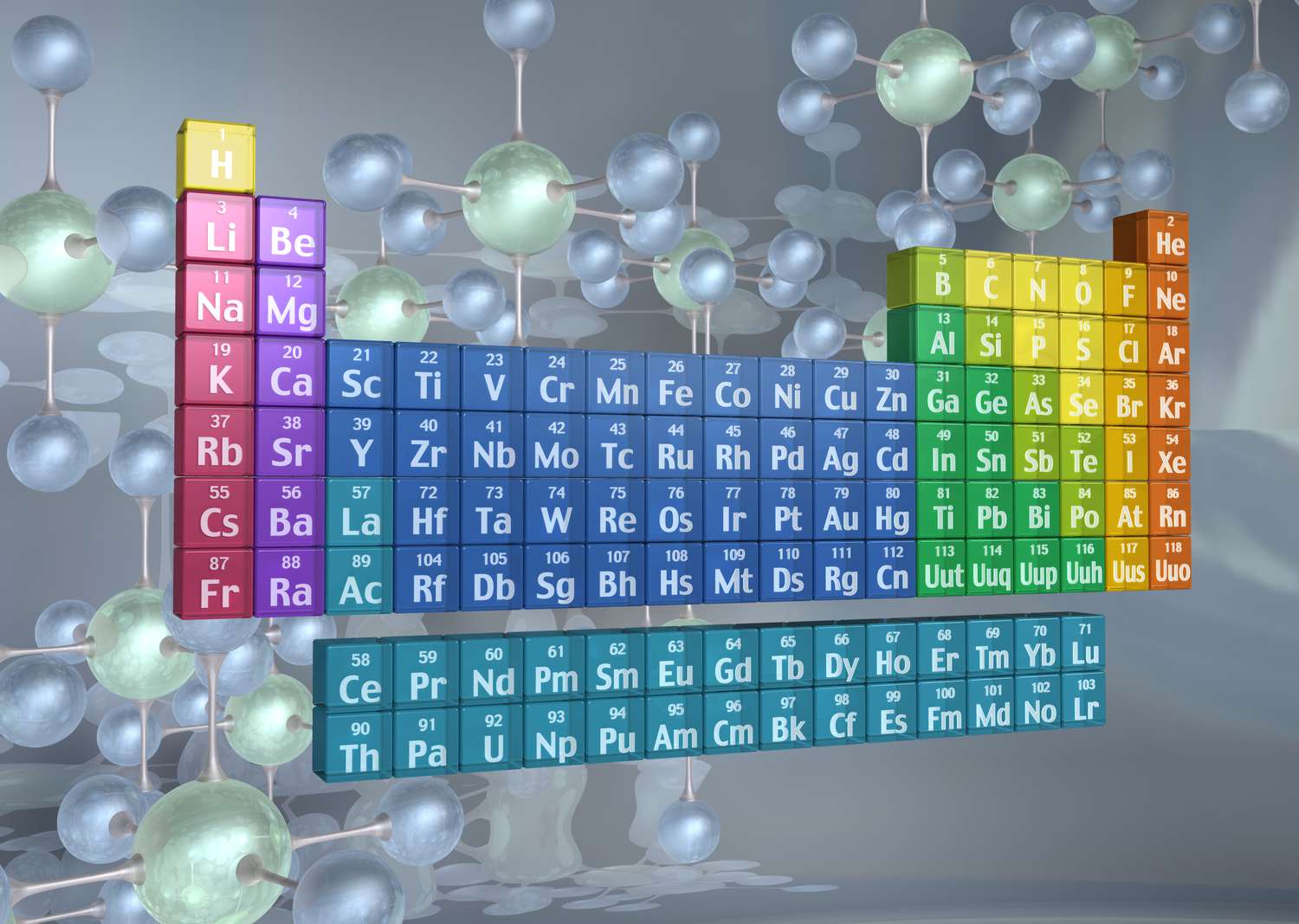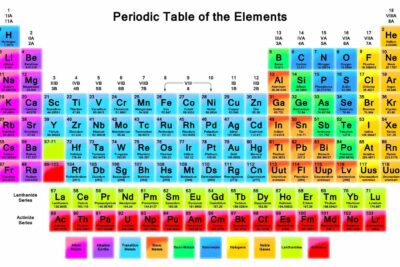
Los elementos pueden clasificarse de acuerdo con familias de elementos. Saber identificar familias, qué elementos se incluyen y sus propiedades ayuda a predecir el comportamiento de elementos desconocidos y sus reacciones químicas.
- Familias de Elementos
- Familias de 5 Elementos
- Familias de 9 Elementos
- Reconocer Familias en la Tabla Periódica
- Metales Alcalinos o Familia de Elementos del Grupo 1
- Metales Alcalinotérreos o Familia de Elementos del Grupo 2
- Familia de Elementos de Metales de Transición
- Grupo de Boro o Familia de Elementos de Metales Terrestres
- Grupo de Carbono o Familia de Elementos Tetrel
- Grupo Nitrógeno o Familia de Elementos Pnictógenos
- Grupo Oxígeno o Familia de Elementos Calcógenos
- Familia de Elementos Halógenos
- Familia de Elementos de Gases Nobles
- Fuentes
Familias de Elementos
Las familias de elementos se indican mediante números ubicados en la parte superior de la tabla periódica.
Lectura relacionada:
 Por qué el CO2 No es un Compuesto Orgánico
Por qué el CO2 No es un Compuesto OrgánicoTodd Helmenstine
Una familia de elementos es un conjunto de elementos que comparten propiedades comunes. Los elementos se clasifican en familias porque las tres categorías principales de elementos (metales, no metales y semimetales) son muy amplias. Las características de los elementos en estas familias están determinadas principalmente por el número de electrones en la capa de energía externa. Los grupos de elementos, por otro lado, son colecciones de elementos categorizados de acuerdo con propiedades similares. Debido a que las propiedades de los elementos están determinadas en gran medida por el comportamiento de los electrones de valencia, las familias y los grupos pueden ser iguales. Sin embargo, hay diferentes maneras de categorizar los elementos en familias. Muchos químicos y libros de texto de química reconocen cinco familias principales:
Lectura relacionada:
 Definición de Tampón-Química y Biología
Definición de Tampón-Química y BiologíaFamilias de 5 Elementos
- Metales alcalinos
- Metales alcalinotérreos
- Metales de transición
- Halógenos
- Gases nobles
Familias de 9 Elementos
Otro método común de categorización reconoce nueve familias de elementos:
- Metales alcalinos: Electrón de valencia del grupo 1 (IA) - 1
- Metales alcalinotérreos: Electrones de valencia del grupo 2 (IIA) - 2
- Metales de transición: Los metales del bloque d y f de los grupos 3-12 tienen 2 electrones de valencia
- Grupo Boro o Metales Terrestres: Electrones de valencia del Grupo 13 (IIIA) - 3
- Grupo carbono o Tetrels: - Grupo 14 (IVA) - 4 electrones de valencia
- Grupo nitrógeno o Pnictógenos: - Grupo 15 (VA) - Electrones de valencia 5
- Grupo oxígeno o Calcógenos: - Grupo 16 (VÍA) - 6 electrones de valencia
- Halógenos: - Grupo 17 (VIIA) - 7 electrones de valencia
- Gases nobles: - Grupo 18 (VIIIA) - 8 electrones de valencia
Lectura relacionada:
 Cómo Desmagnetizar un Imán
Cómo Desmagnetizar un ImánReconocer Familias en la Tabla Periódica
Las columnas de la tabla periódica suelen marcar grupos o familias. Se han utilizado tres sistemas para numerar familias y grupos:
- El sistema IUPAC más antiguo usaba números romanos junto con letras para distinguir entre el lado izquierdo (A) y el derecho (B) de la tabla periódica.
- El sistema CAS utilizó letras para diferenciar los elementos del grupo principal (A) y de transición (B).
- El sistema IUPAC moderno utiliza números arábigos del 1 al 18, simplemente numerando las columnas de la tabla periódica de izquierda a derecha.
Muchas tablas periódicas incluyen números romanos y arábigos. El sistema de numeración árabe es el más ampliamente aceptado en la actualidad.
Metales Alcalinos o Familia de Elementos del Grupo 1
Los elementos resaltados de la tabla periódica pertenecen a la familia de elementos de metales alcalinos.
Todd Helmenstine
Los metales alcalinos se reconocen como un grupo y una familia de elementos. Estos elementos son metales. El sodio y el potasio son ejemplos de elementos de esta familia. El hidrógeno no se considera un metal alcalino porque el gas no muestra las propiedades típicas del grupo. Sin embargo, en las condiciones adecuadas de temperatura y presión, el hidrógeno puede ser un metal alcalino.
- Grupo 1 o IA
- Metales Alcalinos
- 1 electrón de valencia
- Sólidos metálicos blandos
- Brillante, lustroso
- Alta conductividad térmica y eléctrica
- Densidades bajas, que aumentan con la masa atómica
- Puntos de fusión relativamente bajos, que disminuyen con la masa atómica
- Reacción exotérmica vigorosa con agua para producir gas hidrógeno y una solución de hidróxido de metal alcalino
- Se ionizan para perder su electrón, por lo que el ion tiene una carga +1
Metales Alcalinotérreos o Familia de Elementos del Grupo 2
Los elementos resaltados de esta tabla periódica pertenecen a la familia de elementos alcalinotérreos.
Todd Helmenstine
Los metales alcalinotérreos o simplemente tierras alcalinotérreas se reconocen como un grupo y una familia de elementos importantes. Estos elementos son metales. Los ejemplos incluyen calcio y magnesio.
- Grupo 2 o IIA
- Metales Alcalinotérreos (Tierras Alcalinas)
- 2 electrones de valencia
- Sólidos metálicos, más duros que los metales alcalinos
- Brillante, lustroso, oxida fácilmente
- Alta conductividad térmica y eléctrica
- Más denso que los metales alcalinos
- Puntos de fusión más altos que los metales alcalinos
- Reacción exotérmica con agua, que aumenta a medida que avanza por el grupo; el berilio no reacciona con el agua; el magnesio reacciona solo con vapor
- Se ionizan para perder sus electrones de valencia, por lo que el ion tiene una carga +2
Familia de Elementos de Metales de Transición
Los elementos resaltados de esta tabla periódica pertenecen a la familia de elementos de metales de transición. Las series de lantánidos y actínidos debajo del cuerpo de la tabla periódica también son metales de transición.
Todd Helmenstine
La familia más grande de elementos consiste en metales de transición. El centro de la tabla periódica contiene los metales de transición, más las dos filas debajo del cuerpo de la tabla (lantánidos y actínidos) son metales de transición especiales.
- Grupos 3-12
- Metales de Transición o Elementos de Transición
- Los metales del bloque d y f tienen 2 electrones de valencia
- Sólidos metálicos duros
- Brillante, lustroso
- Alta conductividad térmica y eléctrica
- Denso
- Altos puntos de fusión
- Los átomos grandes exhiben un rango de estados de oxidación
Grupo de Boro o Familia de Elementos de Metales Terrestres
Estos son los elementos que pertenecen a la familia del boro.
Todd Helmenstine
El grupo boro o familia de metales terrestres no es tan conocido como algunas de las otras familias de elementos.
- Grupo 13 o IIIA
- Metales del Grupo del Boro o de la Tierra
- 3 electrones de valencia
- Propiedades diversas, intermedias entre las de metales y no metales
- Miembro más conocido: aluminio
Grupo de Carbono o Familia de Elementos Tetrel
Los elementos resaltados pertenecen a la familia de elementos carbon. Estos elementos se conocen colectivamente como tetrels.
Todd Helmenstine
El grupo carbono está formado por elementos llamados tetrels, que se refiere a su capacidad para transportar una carga de 4.
- Grupo 14 o IVA
- Grupo de Carbono o Tetrels
- 4 electrones de valencia
- Propiedades diversas, intermedias entre las de metales y no metales
- Miembro más conocido: carbono, que comúnmente forma 4 enlaces
Grupo Nitrógeno o Familia de Elementos Pnictógenos
Los elementos resaltados pertenecen a la familia del nitrógeno. Estos elementos se conocen colectivamente como pnictógenos.
Todd Helmenstine
Los pnictógenos o grupo nitrógeno es una familia de elementos significativa.
- Grupo 15 o VA
- Grupo Nitrógeno o Pnictógenos
- 5 electrones de valencia
- Propiedades diversas, intermedias entre las de metales y no metales
- Miembro más conocido: nitrógeno
Grupo Oxígeno o Familia de Elementos Calcógenos
Los elementos resaltados pertenecen a la familia del oxígeno. Estos elementos se llaman calcógenos.
Todd Helmenstine
La familia de los calcógenos también se conoce como grupo oxígeno.
- Grupo 16 o VÍA
- Grupo Oxígeno o Calcógenos
- 6 electrones de valencia
- Diversas propiedades, que cambian de no metálicas a metálicas a medida que avanza en la familia
- Miembro más conocido: oxygen
Familia de Elementos Halógenos
Los elementos resaltados de esta tabla periódica pertenecen a la familia de elementos halógenos.
Todd Helmenstine
La familia de los halógenos es un grupo de no metales reactivos.
- Grupo 17 o VIIA
- Halógenos
- 7 electrones de valencia
- No metales reactivos
- Los puntos de fusión y los puntos de ebullición aumentan al aumentar el número atómico
- Altas afinidades electrónicas
- Cambie de estado a medida que avanza en la familia, con flúor y cloro existentes como gases a temperatura ambiente, mientras que el bromo es un líquido y el yodo es un sólido
Familia de Elementos de Gases Nobles
Los elementos resaltados de esta tabla periódica pertenecen a la familia de elementos de los gases nobles.
Todd Helmenstine
Los gases nobles son una familia de no metales no reactivos. Los ejemplos incluyen helio y argón.
- Grupo 18 o VIII A
- Gases Nobles o Gases Inertes
- 8 electrones de valencia
- Normalmente existen como gases monoatómicos, aunque estos elementos forman (raramente) compuestos
- El octeto de electrones estable hace que no sea reactivo (inerte) en circunstancias normales
Fuentes
- Fluck, E. " Nuevas notaciones en la Tabla Periódica." Aplicación Pura. Chem. IUPAC. 60 (3): 431–436. 1988. doi: 10.1351 / pac198860030431
- Leigh, G. J. Nomenclatura de Química Inorgánica: Recomendaciones. Blackwell Science, 1990, Hoboken, N. J.
- Scerri, E. R. La tabla periódica, su historia y su significado. Oxford University Press, 2007, Oxford.