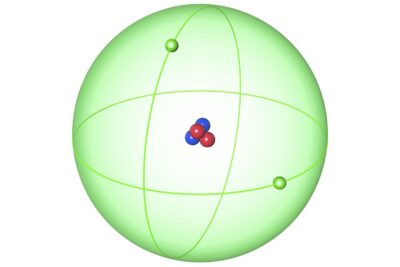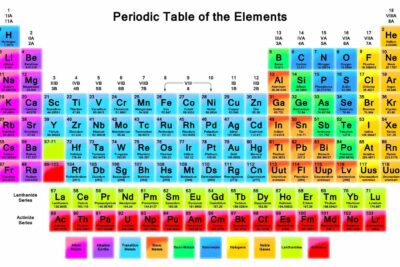
El carbono es el elemento que tiene el número atómico 6 en la tabla periódica, y se identifica con el símbolo "C". Este no metal es fundamental para la química orgánica y, en consecuencia, para la vida misma. Es conocido en distintas formas puras, como el diamante, el grafito y el carbón vegetal, cada uno con características y aplicaciones únicas.
Datos rápidos: Número atómico 6 (14 6 C)
- Nombre del elemento: Carbono
- Número atómico: 6
- Símbolo del elemento: C
- Peso atómico: 12.011
- Grupo de Elementos: Grupo 14 (Familia de Carbonos)
- Categoría: No metal o metaloide
- Configuración Electrónica: [He] 2s2 2p2 (2s22p2)
- Fase en STP: Sólida
- Estados de oxidación: Generalmente +4 o -4, pero también +3, +2, +1, 0, -1, -2, -3
- Descubrimiento: Conocido por los egipcios y sumerios (3750 AEC)
- Reconocido como elemento: Antoine Lavoisier (1789)
El elemento de número atómico 6 es carbono. Las formas de carbono puro incluyen diamante, grafito y carbono amorfo.
Dave King / Imágenes falsas
Datos del Elemento Número Atómico 6
- Cada átomo de carbono tiene 6 protones y electrones, lo que se refleja en su símbolo isotópico común "14 6 C". El elemento existe naturalmente como una mezcla de tres isótopos. La mayor parte de este carbono tiene 6 neutrones (carbono-12), además de pequeñas cantidades de carbono-13 y carbono-14. El carbono-12 y el carbono-13 son estables, mientras que el carbono-14 se utiliza para la datación por radioisótopos de material orgánico. Se conocen un total de 15 isótopos de carbono.
- El carbono puro puede tomar cualquiera de varias formas diferentes, llamadas alótropos. Estos alótropos exhiben propiedades marcadamente diferentes. Por ejemplo, el diamante es la forma más dura de cualquier elemento, mientras que el grafito es muy suave y el grafeno es más resistente que el acero. El diamante es transparente, mientras que otras formas de carbono son de color gris opaco o negro. Todos los alótropos de carbono son sólidos a temperatura y presión ambiente. El descubrimiento del fullereno alótropo ganó el Premio Nobel de Química en 1996.
- El nombre del elemento carbono proviene de la palabra latina carbo, lo que significa carbón. El símbolo del elemento para el número atómico 6 es C. El carbono es uno de los elementos conocidos en forma pura por la humanidad antigua. El hombre primitivo usaba carbono en forma de hollín y carbón vegetal. Los chinos conocían los diamantes desde el año 2500 a.C. El crédito por el descubrimiento del carbono como elemento se le da a Antoine Lavoisier. En 1772, quemó muestras de diamante y carbón vegetal y demostró que cada uno liberaba la misma cantidad de dióxido de carbono por gramo.
- El carbono tiene el punto de fusión más alto de los elementos puros a 3500 ° C (3773 K, 6332 °F).
- El carbono es el segundo elemento más abundante en los seres humanos, en masa (después del oxígeno). Aproximadamente el 20% de la masa de un organismo vivo es de número atómico 6.
- El carbono es el cuarto elemento más abundante en el universo. El elemento se forma en las estrellas a través del proceso triple alfa en el que los átomos de helio se fusionan para formar un número atómico 4 (berilio), que luego se fusiona con el número atómico 2 (helio) para formar un número atómico 6.
- El carbono en la Tierra se recicla constantemente a través del Ciclo del Carbono. Todo el carbono en su cuerpo existió una vez como dióxido de carbono en la atmósfera.
- El carbono puro se considera no tóxico, aunque inhalarlo puede causar daño pulmonar. Las partículas de carbono en el pulmón pueden irritar y desgastar el tejido pulmonar, lo que puede provocar una enfermedad pulmonar. Debido a que las partículas de carbono resisten el ataque químico, tienden a permanecer en el cuerpo (excepto en el sistema digestivo) indefinidamente. El carbono puro, en forma de carbón vegetal o grafito, se puede ingerir de forma segura. Se ha utilizado desde tiempos prehistóricos para hacer tatuajes. Los tatuajes de Otzi el Hombre de Hielo, un cadáver congelado de 5300 años de antigüedad, probablemente se hicieron con carbón vegetal.
- El carbono es la base de la química orgánica. Los organismos vivos contienen cuatro clases de moléculas orgánicas: ácidos nucleicos, grasas, carbohidratos y proteínas.
- El motivo por el cual el número atómico del elemento 6 es tan importante para la vida es debido a su configuración electrónica única, representada por la notación "2s22p2". Tiene cuatro electrones de valencia, pero la capa p es más estable cuando está llena (octeto) o vacía, lo que le da al carbono una valencia habitual de +4 o -4. Con cuatro sitios de unión y un tamaño atómico relativamente pequeño, el carbono puede formar enlaces químicos con una amplia variedad de otros átomos o grupos funcionales. Es un creador de patrones natural, capaz de formar polímeros y moléculas complejas.
- Si bien el carbono puro no es tóxico, algunos de sus compuestos son venenos letales. Estos incluyen ricina y tetrodotoxina.
- En 1961, la IUPAC adoptó el isótopo carbono-12 como base para el sistema de peso atómico.
Lectura relacionada:
 Organic Compound Names and Formulas That Start with A
Organic Compound Names and Formulas That Start with A
Fuentes
- Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Hammond, C. R. (2004). Los Elementos, en Manual de Química y Física (81a ed.). Prensa CRC. ISBN 978-0-8493-0485-9.
- Lide, D. R., ed. (2005). Manual de Química y Física del CRC (86a ed.). Boca Ratón (FL): CRC Press. ISBN 0-8493-0486-5.
- Weast, Robert (1984). CRC, Manual de Química y Física. Boca Ratón, Florida: Publicación de Chemical Rubber Company. pp. E110. ISBN 0-8493-0464-4.
 Definición y Ejemplos de Variables Dependientes
Definición y Ejemplos de Variables Dependientes