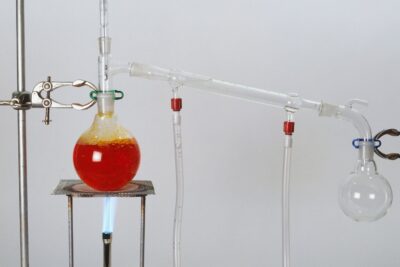
Una reacción de combustión es una clase importante de reacciones químicas, comúnmente conocida como "combustión"."En el sentido más general, la combustión implica una reacción entre cualquier material combustible y un oxidante para formar un producto oxidado. Por lo general, ocurre cuando un hidrocarburo reacciona con oxígeno para producir dióxido de carbono y agua. Las buenas señales de que está lidiando con una reacción de combustión incluyen la presencia de oxígeno como reactivo y dióxido de carbono, agua y calor como productos. Las reacciones de combustión inorgánica pueden no formar todos esos productos, pero siguen siendo reconocibles por la reacción del oxígeno.
Combustión No Significa Necesariamente Fuego
La combustión es una reacción exotérmica, lo que significa que libera calor, pero a veces la reacción avanza tan lentamente que el cambio de temperatura no es perceptible. La combustión no siempre produce fuego, pero cuando lo hace, una llama es un indicador característico de la reacción. Si bien la energía de activación debe superarse para iniciar la combustión (es decir, usar un fósforo encendido para encender un fuego), el calor de una llama puede proporcionar suficiente energía para hacer que la reacción sea autosuficiente.
Lectura relacionada: Ejemplos y Usos de Metales y No Metales
Ejemplos y Usos de Metales y No Metales
Forma General de una Reacción de Combustión
hidrocarburo + oxígeno → dióxido de carbono + agua
Lectura relacionada:
 Orto, Meta y Para en Química Orgánica
Orto, Meta y Para en Química OrgánicaEjemplos de Reacciones de Combustión
Es importante recordar que las reacciones de combustión son fáciles de reconocer porque los productos siempre contienen dióxido de carbono y agua. Aquí hay varios ejemplos de ecuaciones equilibradas para reacciones de combustión. Obsérvese que aunque el gas oxígeno siempre está presente como reactivo, en los ejemplos más complicados, el oxígeno proviene de otro reactivo.
- Combustión de metano
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O (g) - Combustión de naftaleno
C10H8 + 12 O2 → 10 CO2 + 4 Horas2O - Combustión de etano
2 C2H6 + 7 O2 → 4 CO2 + 6 Horas2O - Combustión de butano (comúnmente encontrado en encendedores)
2C4H10g) +13O2(g) → 8CO2(g) +10H2O (g) - Combustión de metanol (también conocido como alcohol de madera)
2 CANALES3OH (g) + 3O2(g) → 2CO2(g) + 4H2O (g) - Combustión de propano (utilizado en parrillas de gas, chimeneas y algunas estufas)
2C3H8(g) + 7O2(g) → 6CO2(g) + 8H2O (g)
Combustión Completa Versus Incompleta
La combustión, como todas las reacciones químicas, no siempre procede con una eficiencia del 100%. Es propenso a limitar los reactivos de la misma manera que otros procesos. Como resultado, es probable que encuentre dos tipos de combustión:
Lectura relacionada: Definición de Acetato - ¿Qué es un Acetato?
Definición de Acetato - ¿Qué es un Acetato?- Combustión Completa: También llamada "combustión limpia", la combustión completa es la oxidación de un hidrocarburo que produce solo dióxido de carbono y agua. Un ejemplo de combustión limpia sería quemar una vela de cera: El calor de la mecha en llamas vaporiza la cera (un hidrocarburo), que a su vez, reacciona con el oxígeno en el aire para liberar dióxido de carbono y agua. Idealmente, toda la cera se quema para que no quede nada una vez que se consume la vela, mientras que el vapor de agua y el dióxido de carbono se disipan en el aire.
- Combustión Incompleta: También llamada "combustión sucia", la combustión incompleta es la oxidación de hidrocarburos que produce monóxido de carbono y/o carbono (hollín) además del dióxido de carbono. Un ejemplo de combustión incompleta sería quemar carbón (un combustible fósil), durante el cual se liberan cantidades de hollín y monóxido de carbono. De hecho, muchos combustibles fósiles, incluido el carbón, se queman de manera incompleta, liberando productos de desecho al medio ambiente.