Los átomos forman enlaces químicos para hacer que sus capas externas de electrones sean más estables. El tipo de enlace químico maximiza la estabilidad de los átomos que lo forman. Un enlace iónico, donde un átomo esencialmente dona un electrón a otro, se forma cuando un átomo se vuelve estable al perder sus electrones externos y los otros átomos se vuelven estables (generalmente al llenar su capa de valencia) al ganar los electrones. Los enlaces covalentes se forman cuando compartir átomos da como resultado la mayor estabilidad. También existen otros tipos de enlaces además de los enlaces químicos iónicos y covalentes.
Enlaces y Electrones de Valencia
La primera capa de electrones solo contiene dos electrones. Un átomo de hidrógeno (número atómico 1) tiene un protón y un electrón solitario, por lo que puede compartir fácilmente su electrón con la capa externa de otro átomo. Un átomo de helio (número atómico 2), tiene dos protones y dos electrones. Los dos electrones completan su capa externa de electrones (la única capa de electrones que tiene), además de que el átomo es eléctricamente neutro de esta manera. Esto hace que el helio sea estable y poco probable que forme un enlace químico.
Lectura relacionada: Tabla Periódica de los Elementos en la que se puede hacer Clic
Tabla Periódica de los Elementos en la que se puede hacer Clic
Más allá del hidrógeno y el helio, es más fácil aplicar la regla del octeto para predecir si dos átomos formarán enlaces y cuántos enlaces formarán. La mayoría de los átomos necesitan ocho electrones para completar su capa exterior. Por lo tanto, un átomo que tiene dos electrones externos a menudo formará un enlace químico con un átomo que carece de dos electrones para estar "completo"."
Por ejemplo, un átomo de sodio tiene un electrón solitario en su capa exterior. Un átomo de cloro, por el contrario, tiene un electrón corto para llenar su capa exterior. El sodio dona fácilmente su electrón externo (formando el Na+ ion, ya que entonces tiene un protón más de lo que tiene electrones), mientras que el cloro acepta fácilmente un electrón donado (lo que hace que el Cl- ion, ya que el cloro es estable cuando tiene un electrón más de lo que tiene protones). El sodio y el cloro forman un enlace iónico entre sí para formar sal de mesa (cloruro de sodio).
Lectura relacionada:
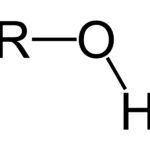 ¿Cómo Se Llama el Grupo Funcional OH?
¿Cómo Se Llama el Grupo Funcional OH?Una Nota Sobre La Carga Eléctrica
Usted puede estar confundido acerca de si la estabilidad de un átomo está relacionada con su carga eléctrica. Un átomo que gana o pierde un electrón para formar un ion es más estable que un átomo neutro si el ion obtiene una capa de electrones completa al formar el ion.
Debido a que los iones con carga opuesta se atraen entre sí, estos átomos formarán fácilmente enlaces químicos entre sí.
Lectura relacionada:
 Definición de Número Atómico - Glosario de Química
Definición de Número Atómico - Glosario de Química¿Por Qué Los Átomos Forman Enlaces?
Puedes usar la tabla periódica para hacer varias predicciones sobre si los átomos formarán enlaces y qué tipo de enlaces podrían formar entre sí. En el extremo derecho de la tabla periódica se encuentra el grupo de elementos llamados gases nobles. Los átomos de estos elementos (por ejemplo, helio, criptón, neón) tienen capas de electrones externas completas. Estos átomos son estables y muy raramente forman enlaces con otros átomos.
Una de las mejores maneras de predecir si los átomos se unirán entre sí y qué tipo de enlaces formarán es comparar los valores de electronegatividad de los átomos. La electronegatividad es una medida de la atracción que un átomo tiene hacia los electrones en un enlace químico.
Una gran diferencia entre los valores de electronegatividad entre átomos indica que un átomo es atraído por electrones, mientras que el otro puede aceptar electrones. Estos átomos normalmente forman enlaces iónicos entre sí. Este tipo de enlace se forma entre un átomo metálico y un átomo no metálico.
Si los valores de electronegatividad entre dos átomos son comparables, aún pueden formar enlaces químicos para aumentar la estabilidad de su capa de electrones de valencia. Estos átomos suelen formar enlaces covalentes.
Puedes buscar valores de electronegatividad para cada átomo para compararlos y decidir si un átomo formará un enlace o no. La electronegatividad es una tendencia de la tabla periódica, por lo que puede hacer predicciones generales sin buscar valores específicos. La electronegatividad aumenta a medida que se mueve de izquierda a derecha a través de la tabla periódica (excepto para los gases nobles). Disminuye a medida que se desplaza hacia abajo en una columna o grupo de la tabla. Los átomos del lado izquierdo de la tabla forman fácilmente enlaces iónicos con los átomos del lado derecho (de nuevo, excepto los gases nobles). Los átomos en el centro de la tabla a menudo forman enlaces metálicos o covalentes entre sí.