¿Qué es el Oro?
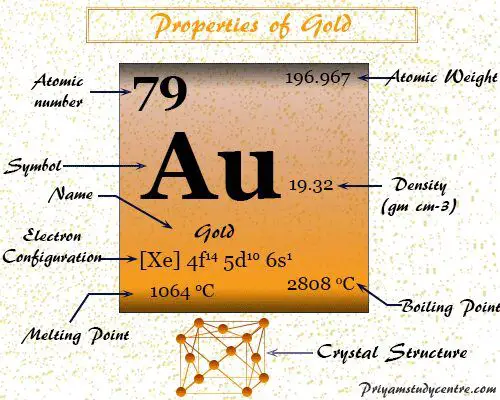
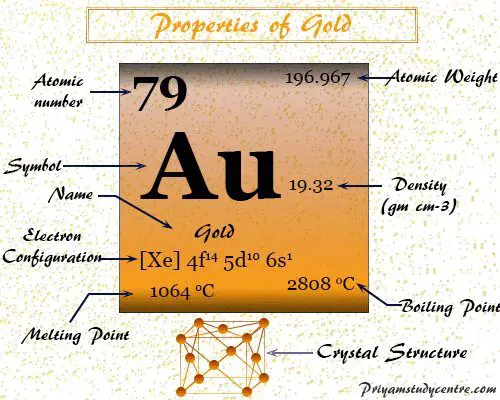
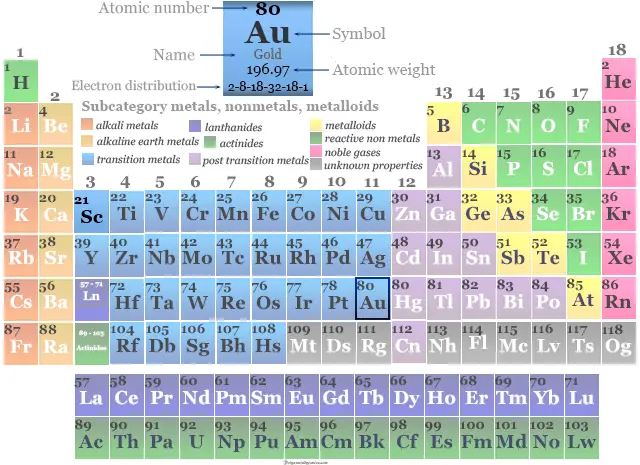
Oro es un elemento químico o bloque d de metal precioso amarillo del grupo 11 o 1B de la tabla periódica con el símbolo Au y el número atómico 79. Es muy utilizado en la antigüedad para fabricar joyas o monedas. El nombre oro se deriva de la palabra en inglés antiguo geolu que significa amarillo y de la palabra latina aurum.
El cobre, la plata y el oro conforman la familia de las monedas o monedas metálicas. Estos metales se encuentran en la naturaleza en forma nativa con propiedades químicas y físicas muy similares en química.
Lectura relacionada: Plata, Símbolo, Propiedades, Uso, Producción, Conexiones
Plata, Símbolo, Propiedades, Uso, Producción, ConexionesLa pureza del oro se expresa en quilates, el oro puro es de 24 quilates y la aleación común con cobre es de 22 quilates.
propiedades del oro
Es químicamente no reactivo, extremadamente maleable, dúctil, de alta densidad (19,32 g−3) metal amarillo dorado. Es un buen conductor del calor y la electricidad.
En el aprendizaje de la química, el característico color amarillo dorado surge de la absorción en la luz ultravioleta de regiones azules del espectro electromagnético correspondientes a la excitación de electrones de la banda llena d a la banda de conducción sp.
Lectura relacionada: Clasificación de aminoácidos
Clasificación de aminoácidosEl metal de la red cristalina centrada en las caras (fcc) en forma sólida.
| Oro |
||
| Símbolo | es | |
| Descubrimiento | alrededor de 3000 aC | |
| Nombre derivado de | La antigua palabra inglesa geolu significa amarillo y de la palabra latina aurum | |
| isótopo común | 79es197 | |
| número CAS | 7440-57-5 | |
| Propiedades periódicas |
||
| número atómico | 79 | |
| Peso atomico | 196.967 | |
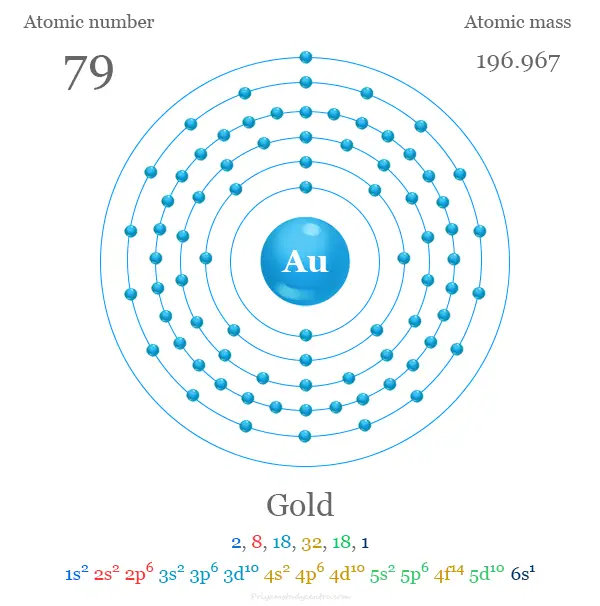
| electrón por celda | 2, 8, 18, 32, 18, 1 | |
| Configuración electrónica | [Xe] 4f14 5d10 6s1 | |
| Grupo | 11 | |
| Período de tiempo | 6 | |
| Bloquear | bloque d | |
| Características físicas |
||
| Condición a 20 °C | firma | |
| punto de encuentro | 1064 °C | |
| Punto de ebullición | 2808 °C | |
| Espesor | 19,32 g/cm23 | |
| Capacidad calorífica molar | 25.418 J mol−1 k−1 | |
| estructura cristalina | cúbico centrado en las caras (fcc) | |
| Resistencia eléctrica | 22,14nm | |
| Propiedades químicas | ||
| Radio atómico (sin consolidar) | 2.14 | |
| Radio covalente | 1.30 | |
| Estados de oxidación | 5.4,3.2, 1,-1 | |
| electronegatividad | 2,54 (escala de Pauling) | |
| Afinidad electronica | ||
| Energía de ionización (kJ mol−1) | 1º | 2do |
| 890.1 | 1980 | |
configuración electrónica del oro
Los 79 electrones del átomo de Au se dividen en diferentes orbitales para dar la siguiente configuración electrónica que se muestra debajo de la imagen,
 Prueba de Mayer para alcaloides: Procedimiento, Mecanismo, Resultados, Usos
Prueba de Mayer para alcaloides: Procedimiento, Mecanismo, Resultados, UsosOro en la tabla periódica
El oro se coloca en el grupo 11 de la tabla periódica con el bloque d o metal de transición.
La configuración electrónica de la escala de valencia Au. [Xe] 4f14 5d10 6s1 con orbital d lleno. Se coloca con metal de transición debido a la presencia del orbital d vacío en número o estado de oxidación +3.
¿Dónde se encuentra el oro?
El oro nativo se encuentra en la naturaleza en dos formas,
- Rif-Au: depositar o dispersar partículas finas en vetas de cuarzo en minas profundas.
- Aluvial-Au: deposición primaria por acción geológica y redepositada en grava de arena aluvial en forma de granos finos.
La forma combinada de oro se encuentra en algunos minerales como calaverita, AuTe2, y sylvanita, (Ag, Au)Te2.
También se encuentra en agua de mar hasta 10−3 ppm, pero no se desarrollaron métodos de extracción para recuperar el metal del agua de mar.
Producción de oro por país
Los 10 principales países productores de oro comercial en el mundo según el informe de 2019 en la tabla a continuación,
| País | Producción de oro (toneladas) |
| Porcelana | 383.2 |
| Rusia | 329.5 |
| Australia | 325.1 |
| Estados Unidos | 200.2 |
| Canadá | 182.9 |
| Perú | 143.3 |
| Ghana | 142.4 |
| Sudáfrica | 118.4 |
| México | 111.4 |
| Brasil | 106.9 |
Pasos de procesamiento de oro
El oro se procesa principalmente a través del proceso de cianuro y fusión.
Proceso de extracción de oro con cianuro
El proceso del cianuro pasa por los siguientes pasos,
- Las rocas finamente pulverizadas se quemaron con una solución diluida de cianuro de sodio (NaCN) y cal en presencia de aire para su oxidación.
4 Au + 8 NaCN + 2 H2O + O2 → 4 na[Au(CN)2] + 4 NaOH - La solución se filtra y el Au se deposita a partir del filtrado mediante virutas de zinc.
Zn + 2Na[Au(CN)2] → 2 Au + Na2[Zn(CN)4] - El zinc se disuelve con ácido sulfúrico diluido y el residuo seco se funde con bórax.
- El oro en bruto contiene cobre, plata y plomo. El plomo se elimina por copelación.
- El cobre se elimina por fusión oxidativa del bórax y la plata se puede eliminar hirviéndola con ácido sulfúrico concentrado.
- La electrólisis es el mejor método para refinar Au.
Proceso de fusión
El proceso de fusión también se utilizó para separar el oro nativo de los depósitos de arena y grava aluviales. Las rocas de grano fino se mezclaron con mercurio con el flujo de agua sobre placas de cobre. La amalgama da miedo y de ella se destila mercurio en retortas de hierro.
Datos interesantes
- La primera energía de ionización de Ag es la más baja de la familia de metales nobles. La suma de las energías de ionización primera y segunda del Cu es la más baja. La suma de las energías de ionización primera, segunda y tercera de Au es la más baja. El hecho sugiere el estado de oxidación común de Cu, Ag y Au.
- Para el oro, las energías de pulverización, ionización e hidratación promueven la formación de Au(III) en soluciones acuosas.
Ingredientes químicos
El oro químicamente no reactivo es el metal de transición más noble de la tabla periódica. No atrae oxígeno, azufre y no reacciona fácilmente con halógenos como moléculas de flúor, cloro, bromo y yodo.
Se disuelve en una solución de cianuro en presencia de peróxido de hidrógeno o agua regia (una mezcla de ácido nítrico concentrado y ácido clorhídrico).
haluro de oro
Aunque puede existir el catión monovalente de oro de tamaño pequeño pero no simple, la mayoría de los compuestos se forman por enlace covalente o en forma de complejos.
El compuesto simple de oro (I) se limita solo a cloro, bromo y yodo. AuCl y AuBr se preparan mediante descomposición térmica controlada de los respectivos haluros.
AuI se prepara calentando el metal con solución de yodo o agregando solución de yodo a AuCl3 solución.
fluoruro de oro
El sólido cristalino anaranjado del fluoruro de Au(III) está formado por la acción del flúor sobre el Au2kl6 a 300°C.
AuF7 y AuF5 son ejemplos de compuestos de Au que exhiben un estado de oxidación mayor que +3 formado por enlace químico covalente.
Óxidos
El óxido, Au2O obtenido por deshidratación de AuOH con metales alcalinos y dióxido de azufre. Au (III) es el estado de oxidación más común del óxido que contiene oro, como el Au. ofertas2O3.
Au marrón amorfo2O32H2El O es precipitado por el álcali de la solución que contiene AuCl. contiene4. El óxido anhidro se obtiene de los compuestos hidratados por encima de P. Secar4O10 seguido de un cuidadoso calentamiento.
cumpliendo oro
Es un polvo explosivo de color verde oliva obtenido por digestión cuidadosa de Au2O3 o su hidrato con amoníaco. El polvo seco explota con un destello cuando se golpea o se calienta. La fórmula probable del Au fulminante es HN=Au-NH21,5 horas2o
conexión compleja
El estado de oxidación +2 es desfavorable en comparación con Au (I) y Au (II) y se han reclamado pocos complejos de Au (II).
Por ejemplo, la sal de tetra-n-butilamonio del bis(maleonitrilo ditiolato)aurato(II).
es2s3 se prepara haciendo reaccionar sulfuro de hidrógeno sobre LiAuCl seco. liderar42H2O a 10°C. El cloruro de litio se separa por extracción con alcohol y se seca a 70°C.
uso de oro
- El oro y sus compuestos son ampliamente utilizados en medicina, tanto en la antigua Ayurveda como en la alopatía moderna. Se utiliza principalmente para tratar la artritis.
- Debido a su color brillante y baja reactividad química, el oro fue el primer metal que atrajo el ojo humano para hacer monedas, varios tipos de joyería artesanal y artículos decorativos.
- Debido a sus propiedades únicas, los materiales se aceptan universalmente en bienes y servicios en forma de monedas o metales preciosos para influir en la moneda mundial.
- La moneda moderna es la moneda de papel, pero el oro juega un papel clave y domina la moneda del país.
- Es aceptado por todos los países como medio para técnicas de pago internacional.
- Un polvo púrpura que contiene un coloide de Au se absorbe en el óxido de estaño (II) hidratado. Se utiliza en la fabricación de vidrio rubí. El polvo púrpura se prepara reduciendo el cloruro de Au(II) con SnCl2.
- Debido a la conductividad eléctrica, la conductividad térmica y las propiedades no reactivas, utilizamos una gran cantidad de oro para fines industriales en ingeniería eléctrica o electrónica.
- Se utiliza para la fabricación de terminales, placas de contacto, circuitos impresos y semiconductores.
¿Qué es el oro de 24 kilates?
El oro puro es de 24 quilates con 24 partes en peso de Au y 2 partes en peso de otros metales.
Está aleado con otros metales por su mayor suavidad y claridad para facilitar su uso en joyería, artículos de oro y fabricación de monedas. Los metales aleados son plata, cobre, zinc, platino y paladio.
El oro aleado con plata se usa para hacer monedas u objetos de oro, y el metal aleado con platino o paladio se usa a menudo para hacer joyas artesanales.