Titanio metálico
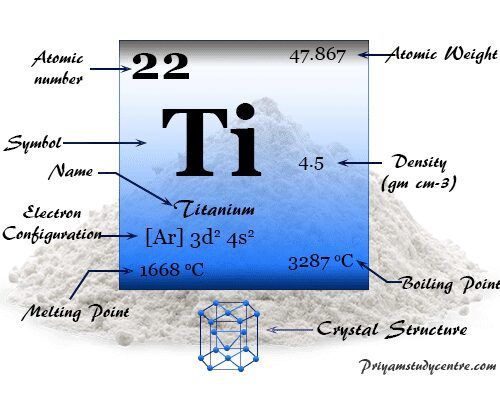
Titanio es un elemento químico o metal plateado ligero del grupo 4 (IVB) en la tabla periódica con el símbolo Ti y número atómico 22. Tiene un alto punto de fusión, buena resistencia a la tracción y propiedades de conductividad térmica y eléctrica. Forma una red cristalina hexagonal densamente empaquetada como la mayoría de los otros metales de transición.
Ti es un metal muy útil ampliamente utilizado en la industria. La aleación de titanio se usa generalmente en aviones de alta velocidad. La configuración electrónica de la capa de valencia de metal es 3d.2 4s2. Por lo tanto, el número de oxidación o estado más alto y más estable del titanio es +4.
Lectura relacionada: Oro, Hechos, Uso, Propiedades, Procesamiento
Oro, Hechos, Uso, Propiedades, Procesamiento¿Quién descubrió el titanio?
En 1791, el químico y mineralogista inglés William Gregor intentó descubrir un nuevo metal a partir del mineral de hierro que contenía titanio, la ilmenita (FeTiO3). Pero en realidad aisló un óxido impuro.
En 1794, el químico alemán Martin Heinrich Klaproth preparó el mismo óxido a partir del mineral rutilo. El nombre del elemento titanio proviene de la palabra griega titanes.
Propiedades del titanio:
Buenas propiedades, resistencia a la corrosión El titanio tiene una configuración electrónica de capa de valencia; [Ar] 3d2 4s2. Por lo tanto, predominó la química del titanio en el estado de oxidación +4.
Lectura relacionada: Plata, Símbolo, Propiedades, Uso, Producción, Conexiones
Plata, Símbolo, Propiedades, Uso, Producción, Conexiones| Titanio |
|||
| Símbolo químico | ti | ||
| Descubrimiento | Guillermo Gregor en 1791 | ||
| Nombre derivado de | Convertirse en titanes, (hijos de la diosa tierra en la mitología griega) | ||
| isótopo común | 48ti | ||
| Propiedades periódicas |
|||
| número atómico | 22 | ||
| Peso atomico | 47.867 | ||
| electrón por escala | 2, 8, 10, 2 | ||
| Configuración electrónica | [Ar] 3d2 4s2 | ||
| Grupo | 4 | ||
| Período de tiempo | 4 | ||
| Bloquear | bloque d | ||
| Características físicas |
|||
| Condición a 20 °C | firma | ||
| punto de encuentro | 1668 °C | ||
| Punto de ebullición | 3287 ºC | ||
| Espesor | 4,50 g/cm23 | ||
| Capacidad calorífica molar | 25,06 J mol−1 k−1 | ||
| estructura cristalina | empaquetado hexagonal (hcp) | ||
| Características físicas |
|||
| Radio atómico (sin consolidar) | 2.11 | ||
| Radio covalente | 1.48 | ||
| Estados de oxidación | 4, 3 | ||
| electronegatividad | 1,54 (escala de Pauling) | ||
| Afinidad electronica | 7.622 kJ mol−1 | ||
| Energía de ionización | 1º | 2do | 3ro |
| 658.81 | 1309.84 | 2652.55 | |
| Resistencia eléctrica | 420 nΩ⋅m a 20 °C | ||
| número CAS | 7440-32-6 | ||
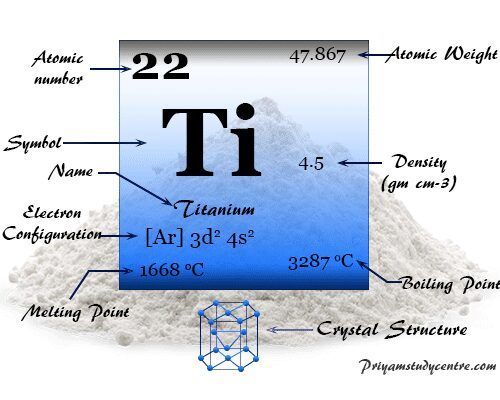
Titanio en la tabla periódica
El metal de transición Ti se coloca en el grupo 4 y el período 4 de la tabla periódica. Es un elemento del bloque d que se encuentra entre el escandio y el vanadio.
 Clasificación de aminoácidos
Clasificación de aminoácidos¿Dónde se encuentra el titanio?
El titanio es el noveno más abundante de todos los elementos y el segundo de los metales de transición. Constituye casi el 0,63 por ciento de la corteza terrestre. La forma combinada de metal se encuentra en la mayoría de las rocas ígneas, arena, arcilla y suelos, en organismos vivos (plantas y animales) y en aguas naturales.
El metal fue aislado por el metalúrgico Berzelius en 1825 y la forma pura por M. Hunter en 1910 usando cloruro de titanio (TiCl4) con un cilindro de acero hermético.
Ilmenita (FeTiO3) y rutilo (TiO2) son dos minerales comerciales de titanio. Se encuentra principalmente en Australia Occidental, Canadá, China, sur de la India, Mozambique, Malasia, Nueva Zelanda, Noruega, Sierra Leona, Sudáfrica y Ucrania.
Isótopos de titanio
El titanio natural consta de cinco isótopos estables como: 46Ti (8,0 por ciento), 47Ti (7,3 por ciento), 48Ti (73,8 por ciento), 49Ti (5,5 por ciento), y 50Ti (5,4 por ciento).
Proceso de producción
La preparación de titanio puro es muy difícil debido a su reactividad a altas temperaturas. La extracción de metal por reducción de carbono provoca una serie de dificultades. Es altamente reactivo a altas temperaturas y forma fácilmente carburo, nitruro y óxido al reaccionar con carbono, oxígeno y nitrógeno, respectivamente.
- La extracción del metal se realiza calentando ilmenita o rutilo con carbón y cloro a 900°C.
- Tetracloruro de titanio (TiCl4), punto de ebullición 137 °C, se separa del FeCl3 por destilación fraccionada.
- el TiCl4 se reduce con magnesio fundido en una atmósfera de argón para producir titanio metálico esponjoso.
TiCl4 + 2 Mg → Ti + 2 MgCl2 - El cloruro de magnesio y el exceso de magnesio se eliminan con agua de lavado y ácido clorhídrico diluido.
- El titanio puro se obtiene calentando el metal con yodo en un tubo de vidrio al vacío provisto de un filamento de tungsteno en el centro del tubo.
Datos sobre el titanio
- El titanio es un metal de transición con un alto punto de fusión, buena resistencia a la tracción y resistencia a la corrosión que está presente en el grupo 4 de la tabla periódica.
- El metal no reacciona a temperatura normal, pero en estado finamente dividido se inflama en el aire (piroforo).
- Cuando se calienta, se combina con no metales como oxígeno, nitrógeno, boro, carbono, silicio e hidrógeno.
- El nitruro (TiN), los carburos (TiC) y los boruros (TiB, TiB2) son compuestos muy duros, buenos conductores de electricidad y químicamente muy inertes.
- El metal se descompone con vapor a 100°C, pero no es atacado por ácidos minerales diluidos como el ácido sulfúrico, clorhídrico o nítrico a temperatura normal.
- No ataca con álcali acuoso caliente, pero el álcali fundido lo ataca para dar titanatos.
Ingredientes químicos
Al aprender química, la configuración electrónica de la capa de valencia del titanio es 3d2 4s2. Por lo tanto, el estado de oxidación más alto y más estable de Ti es +4. Los compuestos con menor estado de oxidación (0, II, III) se oxidaron fácilmente para formar Ti(IV).
Se requiere la alta energía de ionización para hacer el Ti. Dar forma+4 ion. Sugiere que los compuestos químicos del titanio en el estado +4 se forman por enlace covalente.
óxido de titanio
Óxido de titanio (TiO2) tiene tres formas sólidas cristalinas, rutilo, anatasa y brookita. El rutilo es la forma natural más común utilizada en la industria química como pigmento. En todas las estructuras, el Ti está coordinado con seis átomos de oxígeno.
ti2O3El óxido de Ti(III) de color violeta tiene un tipo estructural similar al del α-Al2O3.
TiO puede ser hecho por TiO. calentar2 con metal titanio. Tiene una estructura cristalina cúbica como el cloruro de sodio, pero en su mayoría no estequiométrica con un sexto de sitios vacíos para ambos iones. Se utiliza como conductor de metal.
disulfuro de titanio
El disulfuro (TiS2) es el principal compuesto de sulfuro de titanio formado con átomos de azufre. Consiste en una estructura en capas. Se utiliza como electrodo para el desarrollo de baterías de litio.
haluros
Los cuatro haluros como TiF4TiCl4TiBr4y TiI4 Son conocidos. TiF4 se puede obtener haciendo reaccionar los metales con flúor a 200°C. Se pueden preparar otros tetrahaluros usando TiO. calentar2 con carbono y halógeno.
En el estado de oxidación +3, también forma las cuatro moléculas de haluro. Son insolubles en agua y estables en el aire. Son desproporcionados para formar haluros de Ti(IV).
Compuestos organometálicos
Los compuestos organometálicos de titanio se desarrollaron en 1960 mediante el descubrimiento del catalizador químico Ziegler Natta. Una gran cantidad de compuestos organometálicos se obtienen mediante enlaces químicos, como los enlaces sigma y pi.
El complejo organotitanio más común es el dicloruro de titanoceno. [(C5H5)2TiCl2]. El reactivo de Tebbe y el reactivo de Petasis son los compuestos relacionados del dicloruro de titanoceno.
uso de titanio
- Debido a su alta eficiencia y baja toxicidad biológica, el complejo de titanio (IV) es el primer compuesto sin platino probado para el tratamiento del cáncer en medicina.
- Es un material de aleación impotente debido a su baja densidad, alta resistencia a la tracción y excelente resistencia a la corrosión. La adición de 0,1 por ciento de titanio al acero aumenta la resistencia mecánica y la resistencia a la corrosión de la aleación.
- Las aleaciones de titanio se utilizan en muchos campos químicos e industriales, como el almacenamiento de soluciones alcalinas, compuestos de cloro y otros productos químicos agresivos.
- Las aleaciones de titanio también se utilizan para hacer rieles, ruedas de ferrocarril y excels.
- Sus aleaciones con manganeso, cromo, hierro, molibdeno, aluminio, vanadio y estaño. Estas aleaciones se utilizan en la industria aeroespacial y de misiles debido a su ligereza y resistencia mecánica.
- El ferrotitanio se prepara fundiendo ilmenita o rutilo con hierro y coque en un horno eléctrico. Se utiliza como depurador en la industria siderúrgica para eliminar el oxígeno y el nitrógeno del acero.
- Óxido de titanio (TiO2) es ampliamente utilizado como pigmento blanco por su excelente poder cubriente, el cual se prepara por la misma ruta de extracción de metales.