Cromo
Cromo es un elemento químico o metal de transición duro, maleable, de color blanco grisáceo brillante del Grupo 6 (VIB) de la tabla periódica con número atómico 24 y símbolo cr. Es ampliamente utilizado en la fabricación de acero inoxidable y otras aleaciones.
En 1797, el químico francés Nicolas-Louis Vauquelin descubrió cromo a partir de PbCrO similar a un mineral siberiano.4y el nombre del elemento se deriva del griego last chroma que significa color.
Lectura relacionada: Yodo, Símbolo, Propiedades, Hechos, Conexiones, Uso
Yodo, Símbolo, Propiedades, Hechos, Conexiones, UsoSe detecta fácilmente mediante la prueba de la perla de bórax (verde) y la fusión amarilla de los cromatos se forma tras la fusión con un álcali o un agente oxidante. Los cromatos producen un color azul intenso con peróxido de hidrógeno en una solución ácida.
Propiedades del cromo
Enrejado de cristal cúbico centrado en el cuerpo, el cromo tiene configuración electrónica de escala de valencia [Ar] 3d5 4s1. El punto de fusión y la densidad del cromo son más altos que los del vanadio. Sugiere una menor participación del electrón d en el enlace químico metálico.
El diagrama de estado de oxidación frente a energía libre muestra que el número de oxidación estable o estado del cromo es +3.
Lectura relacionada: Radon, Hechos, Símbolo, Propiedades, Efectos, Uso
Radon, Hechos, Símbolo, Propiedades, Efectos, Uso| Cromo | |||
| Símbolo | cr | ||
| Descubrimiento | Nicolás Louis Vauquelin en 1798 | ||
| Nombre derivado de | La palabra griega croma significa color. | ||
| isótopo común | 52cr | ||
| Estados de oxidación | −4, −2, −1, 0, +1, +2, +3+4, +5, +6 | ||
| número CAS | 7440-47-3 | ||
| Propiedades periódicas | |||
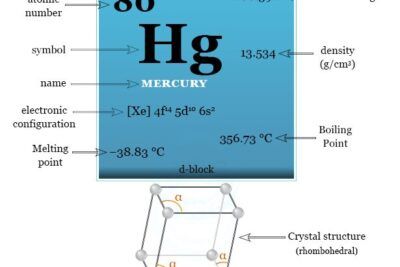
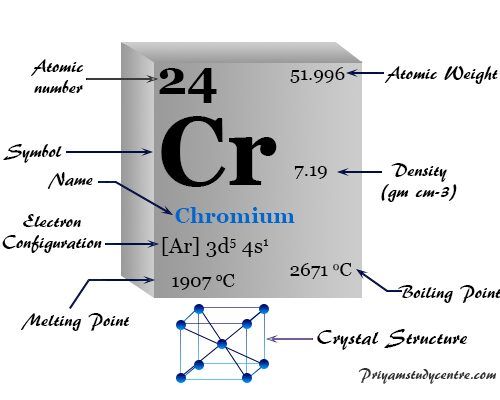
| número atómico | 24 | ||
| Masa atómica relativa | 51,996 | ||
| electrón por celda | 2, 8, 13, 1 | ||
| Configuración electrónica | [Ar] 3d5 4s1 | ||
| Bloquear | bloque d | ||
| Grupo | 6 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1907°C, 3465°F, 2180K | ||
| Punto de ebullición | 2671°C, 4840°F, 2944K | ||
| Capacidad calorífica molar | 23,35 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en el cuerpo (bcc) | ||
| Espesor | 7,15 g/cm23 | ||
| Resistencia eléctrica | 125nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.06 | ||
| Radio covalente | 1.30 | ||
| Electronegatividad | 1,66 (escala de Pauling) | ||
| Afinidad electronica | 64.259 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 652.87 | 1590.63 | 2987.19 | |
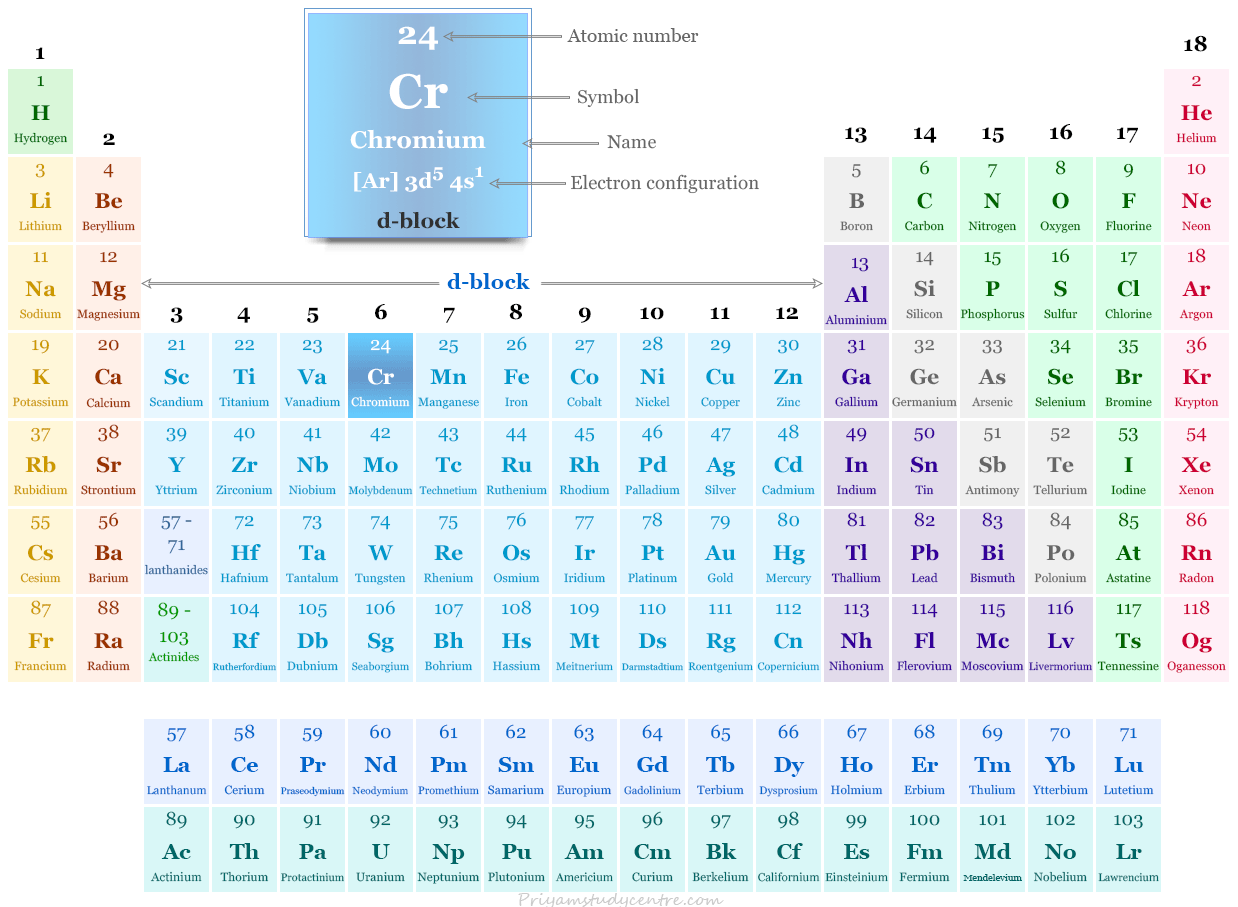
Cromo en la tabla periódica
Se coloca en el grupo 6 y el período 4 de la tabla periódica. El cromo es un metal de transición que se encuentra entre el vanadio y el manganeso.
 Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso
Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso¿Dónde se encuentra el cromo?
Es el vigésimo primer elemento químico más abundante en la corteza terrestre (0,04 por ciento en peso). El cromo se presenta principalmente como cromita (FeCr2O4), que se encuentra en Sudáfrica, India, Filipinas, Turquía y países rusos.
Crocoita (PbCrO4) y cromo ocre (Cr2O3) son los otros minerales del metal que se encuentran en el medio ambiente de la Tierra.
En las piedras preciosas, algunos iones de cromo (Cr+3) los iones son reemplazados por aluminio (Al+3) iones. La presencia de Cr+3 y Cr+4 Los iones en el ambiente terrestre dependen en gran medida de la escala de pH y de las propiedades oxidativas del suelo del sitio.
Isótopos de Cr
Por supuesto, el elemento químico cromo contiene cuatro isótopos estables como: 52Cr (83,76 por ciento), 53Cr (9,55 por ciento), 50Cr (4.31 por ciento), y 54Cr (2,38 por ciento). También tiene diecinueve isótopos radiactivos producidos por varios tipos de desintegración radiactiva o reacciones nucleares.
Extracción de cromo
Metal brillante de color blanco grisáceo, el cromo se extrae de la cromita (Cr2O3).
- El polvo de cromo se calienta (1000°C a 1300°C) con carbonato de sodio y cal viva en un horno de revelación en presencia de exceso de aire.
- El cromo metálico se oxida para formar cromito de sodio y el hierro se convierte en F2O3.
- El cromito de sodio se lixivia con agua y se convierte en dicromato de sodio mediante la adición de ácido sulfúrico concentrado.
- El dicromato producido se reduce a Cr2O3 por calentamiento con carbón.
- El cromo metálico se obtiene por reducción de Cr2O3 por aluminio pulverizado por el proceso Thermite.
cr2O3 + 2 Al → Al2O3 + Cr - La forma pura del elemento se puede obtener reduciendo el cloruro de Cr (III) con calcio metálico en la solución de fusión de CaCl.2 o BaCl2.
Datos interesantes sobre el cromo
- El cromo es el cuarto metal de transición después del escandio, el titanio y el vanadio en la tabla periódica de configuración electrónica. [Ar] 3d5 4s1.
- La configuración electrónica de Cr viola el principio de Aufbau mediante la inclusión de orbitales 3D para formar una nueva configuración electrónica para obtener estabilidad química adicional mediante el intercambio de energía.
- Se disuelve lentamente en ácidos clorhídrico y sulfúrico diluidos con hidrógeno en evolución, pero en ácido nítrico concentrado forma una capa de óxido impermeable.
- En química, el estado de oxidación habitual y dominado del cromo es +3 y +6, también forma compuestos organometálicos en los estados de oxidación +1, +2, +4 y +5.
Ingredientes químicos
Óxido de cromo
El cromo metálico ofrece una buena cantidad de compuestos de Cr(II), incluidos óxidos y dihaluros. Los óxidos son CrO, un polvo negro formado por la exposición de la amalgama de cromo al aire. No está bien caracterizado.
El estado de oxidación común y más estable del metal es Cr(III). Forma el catión trivalente más estable en solución acuosa y una serie de complejos metálicos inertes sustituidos. El óxido, Cr2O3 se forma quemando cromo en oxígeno o calentando dicromato de amonio.
Óxido de cromo (VI)
El principal óxido de cromo en el estado +VI es CrO3. El trióxido de cromo se forma agregando ácido sulfúrico concentrado a una solución acuosa concentrada de dicromato de potasio.
El óxido es altamente ácido y soluble en una solución acuosa de H. Dar forma2CRO4 (escala de pH = 1), HCrO4 (escala de pH > 1), y Cr2O7−2. Es un poderoso agente oxidante que oxida la mayoría de los materiales como el papel, el azúcar, el ácido oxálico y el alcohol.
El ácido acético glacial no se oxida y la solución de ácido acético glacial de trióxido de cromo se usa como agente oxidante en química.
haluros de cromo
Los cuatro dihaluros (CrF2CrCl2CrBr2y CrI2) se obtiene por CrX. disminuir3 con hidrógeno o por reducción del metal y HX gaseoso o yodo a 700°C a 1000°C.
Todos los haluros de Cr(II) son de naturaleza reductora, pueden liberar hidrógeno del agua en ausencia de un agente oxidante.
Los tres haluros como CrCl3 (rojo-violeta), CrBr3 (verde oscuro), y CrI3 (verde oscuro) se preparan mediante una combinación directa del metal con haluros como cloro, bromo y yodo en diferentes rangos de temperatura.
Compuestos de Cromo (III)
Color verde, CrF3 se prepara por combinación directa del metal con flúor, pero se prepara mejor con CrCl. calentar3 con HF a 500 °C.
Los compuestos de sulfuro se pueden hacer por reacción directa de cromo con azufre o CrCl anhidro.3 con sulfuro de hidrógeno.
Compuestos de Cr(VI)
Los compuestos de cromo (VI) son muy impotentes y limitados, las principales especies en el estado +6 son CrO3CrF inestable6los oxohalogenuros CrOX4 (X = F, Cl), CrO3X2y cromo3Xlos aniones oxo y la molécula peroxo.
Cloruro de cromilo
El cloruro de cromilo es el principal oxohaluro de Cr(VI) que se forma cuando el cloruro iónico se calienta con dicromato de potasio y H2 concentrado.2ASI QUE4.
Es un agente oxidante violento que es inflamable en fósforo, azufre, alcohol, etc. El cloruro de cromilo forma otro agente oxidante violento cuando reacciona con el pentóxido de nitrógeno (N2O5).
Los cromatos y dicromatos de sodio o potasio también son dos sustancias químicas importantes del cromo ampliamente utilizadas como agente oxidante y análisis de reacciones redox.
uso de cromo
Alrededor del 85 por ciento del cromo se utiliza en la fabricación de acero inoxidable y otras aleaciones en la metalurgia, el lote de recuerdo se utiliza en varios tipos de industrias químicas, refractarias y. Hace que el acero sea duro y resistente a la corrosión.
- El acero cromado (1,2 a 2 por ciento de Cr) se usa ampliamente en herramientas de corte, tuberías de aceite, molduras de automóviles, blindaje y fabricación de cojinetes de bolas.
- Los aceros con mayor contacto de cromo (17 a 18 por ciento) y 7 por ciento de níquel tienen una resistencia a la corrosión superior que se usa en motores a reacción, turbinas de gas y suplementos estructurales comunes.
- El acero Cr vanadio (1 por ciento Cr y 0,15 por ciento de vanadio) y el acero Cr tungsteno (3,8 por ciento Cr y 14 20 por ciento W) se utilizan para fabricar resortes, ejes, ejes y varios tipos de herramientas de alta velocidad.
- El nicromo (60 por ciento de Ni, 14 por ciento de Cr, 25 por ciento de hierro y 0,2-1 por ciento de carbono) se usa en bobinas de resistencia de calentamiento eléctrico debido a su alto punto de fusión, alta resistencia eléctrica y propiedades de baja oxidación.
- Varios compuestos de cromo se utilizan como catalizadores químicos para la producción de hidrocarburos.
- Se utiliza como pigmento por sus colores verde, amarillo, rojo y naranja brillantes.
- La sal de cromo se utiliza para conservar la madera debido a la naturaleza tóxica de las sales de Cr(IV).
- Alrededor del 90 por ciento del cuero se curte con alumbre de cromo y compuestos de sulfato de Cr(III).
- El cromo también se usa en el cromado, que no causa daños por los compuestos de azufre presentes en la atmósfera terrestre.