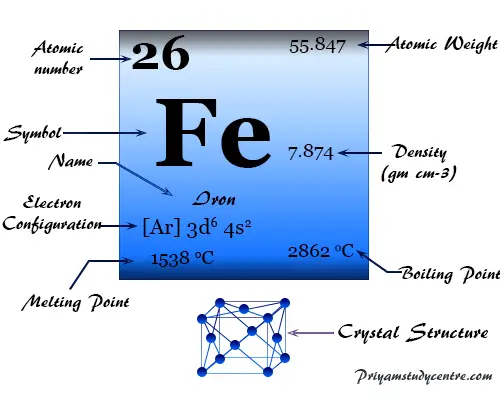
El Hierro es un elemento químico, metal blanco plateado, brillante, maleable y dúctil del grupo 8 (VIIIB) de la tabla periódica con el símbolo Fe y número atómico 26. Es el metal más útil y más barato utilizado por una civilización humana mucho más tarde que el cobre, la plata y el oro.
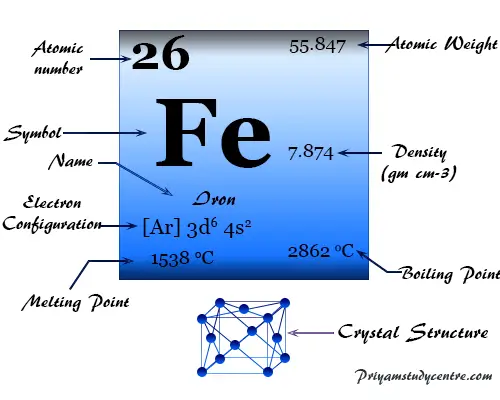
Al aprender química, el elemento químico hierro se ha incluido en la familia de los metales de transición debido a la presencia de orbitales d incompletos en su estado atómico o iónico.
Lectura relacionada: Azufre, Hechos, Propiedades, Producción, Uso
Azufre, Hechos, Propiedades, Producción, UsoEl nombre proviene de la antigua palabra inglesa iren, mientras que el símbolo del hierro proviene de la palabra latina Ferrum.
Propiedades físicas y químicas
Propiedades fisicas del hierro
El hierro tiene cuatro redes cristalinas alotrópicas,
- α-Fe (ferromagnético bcc)
- β-Fe (bcc paramagnético)
- γ-Fe (fcc paramagnético)
- δ-Fe (bcc paramagnético)
Es el más magnético de todos los elementos y un metal moderadamente químicamente activo en el entorno terrestre.
Lectura relacionada: Cobre, Hechos, Símbolo, Propiedades, Conexiones, Uso
Cobre, Hechos, Símbolo, Propiedades, Conexiones, Uso| Hierro | |||
| Símbolo | Fe | ||
| Descubrimiento | alrededor de 3500 aC | ||
| Nombre derivado de | El nombre anglosajón iren y símbolo del hierro proviene de la palabra latina Ferrum | ||
| isótopo común | 26Fe56 | ||
| Estados de oxidación | +6, +3, +20, −2 | ||
| número CAS | 7439-89-6 | ||
| Propiedades periódicas | |||
| número atómico | 26 | ||
| Masa atómica relativa | 55.845 | ||
| electrón por celda | 2, 8, 14, 2 | ||
| Configuración electrónica | [Ar] 3d6 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 8 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1538°C, 2800°F, 1811K | ||
| Punto de ebullición | 2861°C, 5182°F, 3134K | ||
| Capacidad calorífica molar | 25,10 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en el cuerpo (bcc) o cúbico centrado en las caras (fcc) | ||
| Espesor | 7,87 g/cm3 | ||
| Resistencia eléctrica | 96,1 nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.04 | ||
| Radio covalente | 1.24 | ||
| Electronegatividad | 1,83 (escala de Pauling) | ||
| Afinidad electronica | 14.569 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 762.47 | 1561.88 | 2957.47 | |
Propiedades químicas del hierro
El segundo metal más común, el hierro, tiene la configuración de valencia electrónica [Ar] 3d6 4s2y número de oxidación común +2 y +3.
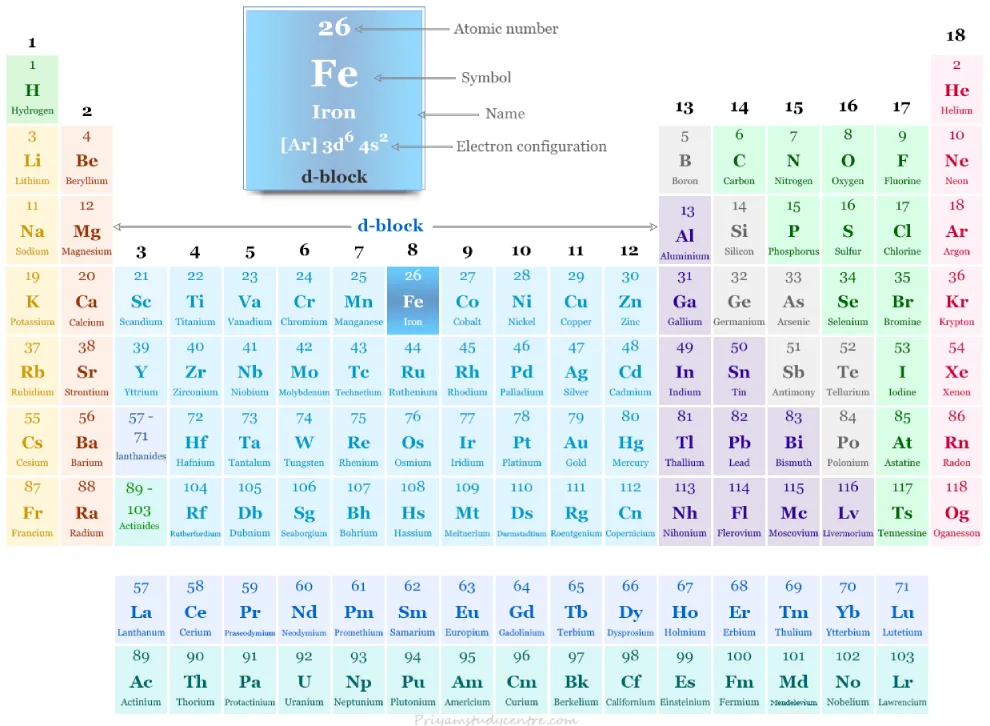
Hierro en la tabla periódica
El hierro se coloca en el grupo 8 y el período 4 en la tabla periódica. Es un metal de transición que se encuentra entre el manganeso y el cobalto.
 Fluor, Símbolo, Descubrimiento, Propiedades, Uso, Hechos
Fluor, Símbolo, Descubrimiento, Propiedades, Uso, HechosHistoria del Hierro
¿Dónde se encuentra el hierro?
El hierro es el metal más común después del aluminio. Es el cuarto elemento químico más abundante después del oxígeno, el silicio y el aluminio en la corteza terrestre y se encuentra en más del 5 por ciento o 50 000 ppm.
En la corteza terrestre, el metal libre es raro, el hierro terrestre en las rocas basálticas que se encuentran en Groenlandia. Los sedimentos carbonosos se encuentran en los Estados Unidos (Missouri).
Alrededor del 0,5 por ciento del suelo lunar se compone de hierro metálico, lo que significa que hay una gran cantidad de Fe en la superficie de la luna.
Minerales de hierro y su fórmula
Los minerales y minerales de óxido más comunes que se encuentran en la corteza terrestre pueden incluir:
- hematita roja (Fe2O3)
- hematita marrón o limonita (2F2O33H2O)
- magnetita (Fe2O3),
- siderita (FeCO3)
- pirita (FeS2)
Las piritas no pueden ser económicas para producir Fe y, por lo tanto, las piritas no se consideran un mineral de Fe.
Los minerales se pueden encontrar en diferentes países como China, Brasil, Australia, Estados Unidos e India.
Cada año se producen 1000 millones de toneladas de hierro en todo el mundo. La producción de acero bruto después de 1996 en todo el mundo es de unos 700 millones de toneladas.
Isótopos
El hierro se produce en la naturaleza debido a cuatro isótopos estables como 54Fe (5,845%), 56Fe (91,754 por ciento), 57Fe (2,119 por ciento), y 58Fe (0,282 por ciento).
Proceso de producción
El hierro se extrae por reducción de carbono en un alto horno.
- El mineral, el coque y la piedra caliza (normalmente en una proporción de 8:4:1) entran por la parte superior del horno, mientras que una ráfaga de aire precalentado a unos 900 °C se vuelve marrón a través de los agujeros cerca de la parte inferior.
- La combustión del coque produce calor cerca de la base a una temperatura de casi 2000°C y desciende gradualmente hasta la parte superior del horno (400°C).
- Cuando el carbono se quema por encima de los 700 °C, el monóxido de carbono sube a la superficie y el Fe . reduce2O3 y FeO. Una parte de la reducción se realiza con carbono.
- La piedra caliza se descompone alrededor de 900°C para dar CaO que se combina con sílice para formar escoria (CaSiO3).
¿Qué es el arrabio?
La escoria fundida y el metal bruto se acumulan en la base del alto horno donde forman capas separadas y la escoria flota sobre el metal fundido, evitando la oxidación. Estos se sumergen a través de orificios individuales y se dejan solidificar en el molde de arena para formar arrabio o hierro fundido que contiene impurezas como carbono, silicio, fósforo, azufre y manganeso.
Cuando se eliminan la mayoría de las impurezas presentes en el hierro porcino, se forma la forma comercial pura del metal, conocida como hierro forjado.
Datos interesantes sobre el hierro.
- El hierro puro es químicamente moderadamente activo, blanco plateado brillante, maleable, metal maleable y la sustancia más magnética de todos los elementos de la tabla periódica.
- El metal finamente dividido es pirofórico en el aire a temperatura ambiente.
- El agua reacciona por encima de los 500 °C, liberando hidrógeno y Fe. se está formando2O3 y FeO.
- En un estado calentado y finamente dividido, reacciona con todos los no metales (carbono, silicio, nitrógeno, fósforo e hidrógeno) para formar compuestos metálicos sólidos, Fe3C, fe3si, fe3P, fe4N, FeN o compuestos iónicos binarios a covalentes como FeF3FeCl3FeS.
- El carburo sólido cristalino duro Fe3C (cementita) es el principal responsable de la variación de las propiedades del acero.
- En ausencia de oxígeno, el hierro reacciona con los ácidos minerales (ácido sulfúrico, clorhídrico o nítrico) para dar iones Fe(II) en solución.
- Las soluciones alcalinas diluidas y el agua sin aire apenas atacan al Fe, pero los hidróxidos alcalinos concentrados calientes lo atacan.
Ingredientes químicos
En química, el hierro tiene propiedades características de los metales de transición con diferentes estados de oxidación y diferentes tipos de coordinación y compuestos químicos organometálicos en diferentes tipos de enlaces químicos.
Los estados de oxidación +2 (ferroso) y +3 (ferroso) son los principales estados de oxidación del Fe para formar una gran cantidad de compuestos en química.
En Fe(II) forma compuestos simples como óxidos, haluros (excepto yodo), y otras sales, junto con un gran número de compuestos complejos. FeF3FeCl3y febrero3 son los haluros de Fe, formados por la reacción directa de los metales con los respectivos halógenos como el flúor, el cloro y el bromo.
El Fe(II) es de naturaleza reductora y forma una gran cantidad de compuestos simples y complejos que son bastante estables en el estado +2. Los haluros, nitrato, perclorato y sulfato son solubles en agua, pero el hidróxido, carbonato, fosfato y oxalato son poco solubles.
Ocurre en un estado de oxidación más alto en ferrato de potasio púrpura (KFeO4) con un estado de oxidación de +6, obtenido por oxidación de Fe(III) por ácido clorhídrico.
¿Para qué se usa el hierro?
El hierro y el acero se utilizan principalmente en los diversos tipos de unidades estructurales de la civilización moderna y la ingeniería civil. Existen diferentes tipos de acero con diferentes propiedades y aplicaciones, fabricados mediante la aleación de hierro con carbono y otros elementos químicos.
- El acero dulce se usa más comúnmente en puentes, torres eléctricas, cadenas de bicicletas, herramientas de corte y cañones de armas.
- También se utiliza como catalizador químico en el proceso Haber para la producción de amoníaco.
- Se utiliza como agente reductor en la producción a pequeña escala de hidrógeno.
- El acero inoxidable es una importante aleación de hierro que contiene al menos de 12 a 15 por ciento de cromo y otros metales como níquel, molibdeno, titanio y cobre que son resistentes a la corrosión y la acción de los ácidos. Es ampliamente utilizado en arquitectura, rodamientos, cuchillería, instrumentos quirúrgicos medicinales y joyería.
- El hierro fundido es otra aleación que contiene de 3 a 5 por ciento de carbono y se usa ampliamente en la fabricación de tuberías, válvulas, bombas e imanes.
Función del hierro en el cuerpo.
Es un elemento esencial no tóxico para todas las formas de vida (plantas y animales). Hay una gran cantidad de iones de hierro presentes en la hemoglobina de la sangre que transporta oxígeno desde los pulmones a la célula para la respiración del cuerpo.
Deficiencia de hierro
La deficiencia de hierro en el cuerpo humano provoca anemia, que es el trastorno de neutralización más común en todo el mundo, tanto en países desarrollados como subdesarrollados.
La pérdida crónica de sangre, el embarazo repetido y el infarto por anquilostomiasis pueden causar anemia en el cuerpo humano. La anemia se caracteriza por una concentración más baja de hierro en la hemoglobina de la sangre (<12 mg/litro), lo que provoca retraso en el crecimiento, pérdida de apetito, actividades metabólicas lentas y una postura aburrida o inactiva.