¿Qué es el oxígeno?
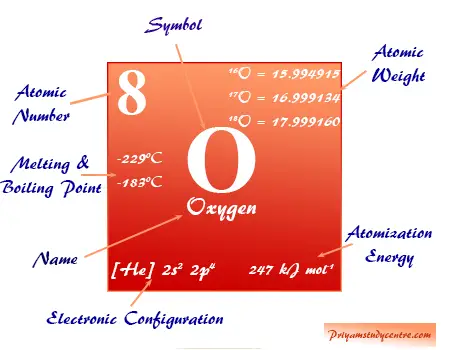
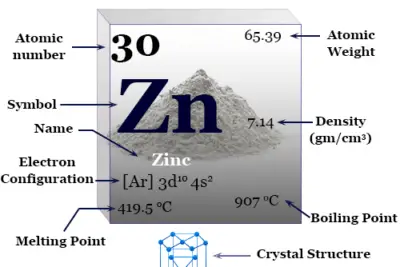
Oxígeno, el número atómico 8, símbolo O y fórmula molecular O2 es el elemento químico más abundante del grupo 16 o familia de los calcógenos en la tabla periódica. Constituye hasta el 47 por ciento de la corteza terrestre en forma de óxidos líquidos y sólidos, oxoácidos y formas gaseosas. El oxígeno es esencial para los organismos vivos (plantas y animales).
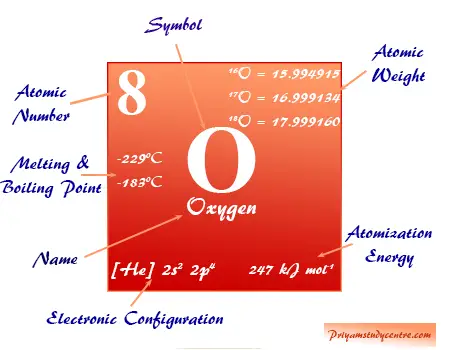
El átomo de oxígeno elemental es una mezcla isotópica de isótopos O-16, O-17 y O-18 que se encuentran en el entorno natural, 21 por ciento en volumen en el aire y 86 por ciento en peso en agua líquida en los océanos.
Lectura relacionada: Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, Uso
Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, UsoIsótopos de Oxígeno y sus Aplicaciones
El O-17 y el O-18 se preparan por destilación fraccionada o electrólisis de moléculas de agua o difusión térmica de gas oxígeno. Isótopo de oxígeno elemental (número de masa = 18) utilizado como trazador en cinética química y estudios mecánicos, pero O-17 (número de masa = 17) se utiliza en el análisis de espectro de RMN.
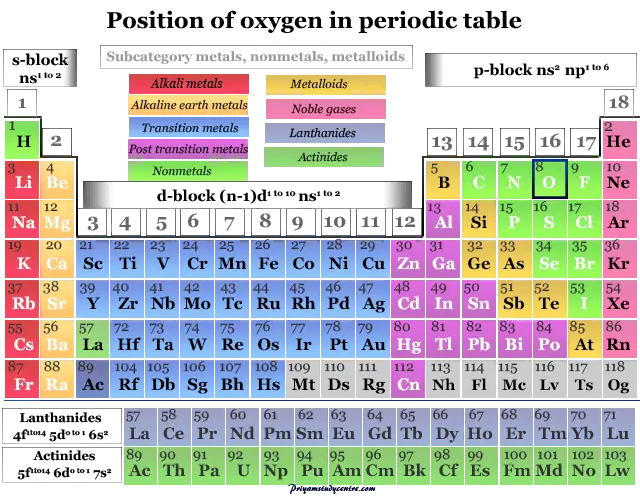
Oxígeno en la tabla periódica
El oxígeno elemento químico no metálico se coloca en el grupo 16 de la tabla periódica. Es un elemento de bloque p colocado con azufre, selenio, telurio y polonio debajo de la imagen.
 Rodio - metal, precio, uso
Rodio - metal, precio, usoPropiedades
| Oxígeno |
|||
| Símbolo | O | ||
| Descubrimiento | Joseph Priestley e independiente por Carl Wilhelm Scheele en 1774 | ||
| Nombre derivado de | La palabra griegaoxigenen, que significa formador de ácido | ||
| alótropos | O2 y O3 | ||
| isótopo común | 8Odieciséis | ||
| estructura cristalina | Red cristalina cúbica | ||
| Propiedades periódicas |
|||
| número atómico | 8 | ||
| electrón por escala | 2, 6 | ||
| Peso atomico | 15,999 | ||
| Configuración electrónica | 1s2 2s2 2p4 | ||
| Grupo | dieciséis | ||
| Período de tiempo | 2 | ||
| Bloquear | bloque p | ||
| Características físicas |
|||
| Condición a 20 °C | Gas | ||
| Punto de fusion | -218,79 °C, -361,82 °F, 54,36 K | ||
| Punto de ebullición | -182,96 °C, -297,33 °F, 90,19 K | ||
| Espesor | 0.001308 gcm−3 | ||
| Propiedades químicas |
|||
| Radio atómico (sin consolidar) | 1.52 | ||
| Radio covalente | 0,64 | ||
| número de oxidación o estados | −1, −2 | ||
| Energía de ionización (kJ mol−1) | 1º | 2do | 3ro |
| 1313.94 | 3388.67 | 5300.47 | |
| Afinidad electronica | 140.976 kJ mol−1 | ||
| Electronegatividad | 3.44 (escala de Pauling) | ||
| Capacidad calorífica molar |
29,378 J mol−1 k−1 | ||
| número CAS | 7782-44-7 | ||
Propiedades físicas del oxígeno
El oxígeno (masa molecular = 16 g/mol) es un gas incoloro, inodoro e insípido que existe en dos formas alotrópicas, como el dioxígeno (peso molecular = 32 g/mol) y el gas ozono (peso molecular = 48 g/mol). El incoloro, desordenado O2 La molécula de gas es de naturaleza paramagnética con dos electrones desapareados.
El dioxígeno es bastante soluble en agua y altamente soluble en solventes orgánicos como la acetona y el benceno y forma complejos débiles de transferencia de carga. Es un líquido azul claro pero una red cristalina sólida azul. La molécula de oxígeno gaseoso es incolora pero en forma líquida o sólida, un solo fotón choca con otras moléculas y excita a ambas. La absorción de la radiación del espectro electromagnético en la región roja a la región verde visible da el color azul observado.
Lectura relacionada: Lutecio, Uso, Símbolo, Hechos, Precio
Lutecio, Uso, Símbolo, Hechos, PrecioPropiedades químicas
El oxígeno (punto de medición = − 229 °C y punto de ebullición = − 183 °C) tiene una energía de ionización muy alta entre los elementos químicos del grupo 16 con un carácter metálico muy bajo, comúnmente conocido como no metal.
Con el aumento del número atómico en el grupo 16, la resistencia de los elementos disminuye. El oxígeno y el azufre son aislantes, el selenio y el telurio son semiconductores, pero el polonio es un conductor metálico de energía eléctrica.
Unión en la molécula de oxígeno
por los 2s2 2p4 fórmula electrónica externa, el oxígeno elemental generalmente exhibe un número o estado de oxidación -2 en un compuesto químico. Los elementos están a dos electrones de distancia de la siguiente configuración de gas noble. Por lo tanto, el enlace con estos dos electrones se logra mediante la obtención de dos electrones por elementos electropositivos o mediante la formación de dos enlaces covalentes simples o un enlace doble con otros elementos.
Posee electronegatividad y afinidad electrónica muy elevadas favoreciendo la formación de compuestos sólidos cristalinos con metales alcalinos (litio, sodio, potasio) y alcalinotérreos (berilio, magnesio, calcio).
Datos interesantes sobre el oxígeno.
Al aprender química, la capa cuántica externa consiste en los 2s.2 2p3 Configuración electrónica. Los datos interesantes sobre el oxígeno solo en el grupo-16 o familia de los calcógenos, no poseen un orbital d. Por lo tanto, el oxígeno solo muestra valencia 2, pero debido a la presencia de orbitales d vacíos, otros elementos como el azufre, el selenio, el telurio y el polonio tienen valencias 2, 4 y 6 para fines de enlace químico.
Diagrama orbital molecular del oxígeno
En el estado fundamental, el diagrama molecular ocupado más alto del O2 La molécula muestra los dos electrones (espín paralelo) en dos orbitales antienlazantes pi. Se dice que es el estado triplete. Pero el siguiente estado superior es uno en el que los electrones están emparejados por espín en orbitales moleculares antienlazantes pi. Estos estados se denominan estados singlete. Normalmente, una transición de triplete a singlete está prohibida.
Proceso de producción
Oxígeno elemento o molécula de gas obtenido industrialmente por destilación fraccionada del aire líquido. En el laboratorio, se puede preparar a partir de varios compuestos químicos como peróxido de hidrógeno, clorato de potasio, permanganato de potasio, etc. Se produce por la descomposición catalítica del peróxido de hidrógeno sobre el catalizador de platino en una lámina de níquel.
Preparación de oxígeno a partir de clorato de potasio.
La descomposición térmica del clorato de potasio produce oxígeno a 400° a 500°C.
2 KClO3 → 2 KCl + O2
Si usamos dióxido de manganeso como catalizador químico, la reacción tiene lugar a 150°C. Pero este proceso también produce 3 por ciento de ClO2.
La descomposición térmica del permanganato de potasio puro en vacío a calor específico produce una molécula de O2 muy pura.
2 KMnO4 → k2MnO4 + MnO2 +O2.
¿Para qué se usa el oxígeno?
El oxígeno es el tercer químico en el orden de uso en la industria, después del ácido sulfúrico y el nitrógeno, y cerca de 100 millones de toneladas de criaturas se consumen anualmente en todo el mundo.
- Se utiliza en gran medida en la metalurgia, como la fabricación de acero en altos hornos y convertidores Bessemer.
- También se utiliza en la oxidación directa en muchos procesos químicos.
- El incoloro, inodoro, insípido O2 molécula de gas utilizada para hacer gas de síntesis en química.
- En química orgánica, se utiliza para oxidar hidrocarburos orgánicos como metano, etano, etileno, acetileno, etc.
- Es un oxidante para los combustibles en la propulsión de cohetes.
Uso en nuestro cuerpo
Es un elemento químico esencial para el organismo animal o vegetal. Lo llevan a cabo dos metaloproteínas como son la hemoglobina y la mioglobina de nuestro organismo. Además de la hemoglobina y la mioglobina, existen otras dos proteínas transportadoras de dioxígeno, las hemocianinas y la hemeritrina. La hemeritrina se encuentra en los invertebrados marinos.
Un ser humano adulto contiene alrededor de 5 litros de sangre. Cada mililitro de sangre contiene 5000 millones de células sanguíneas y cada célula contiene 0,25 millones de moléculas de hemoglobina. Los glóbulos rojos tienen una vida útil de 100 a 120 días. Por lo tanto, el 1 por ciento de las moléculas de hemoglobina se reemplaza diariamente.
Transporte de oxígeno en la sangre
La hemoglobina es esencial para el transporte de oxígeno en nuestro cuerpo. La mioglobina participa en el almacenamiento de O2 en el tejido muscular y se usa según sea necesario. El oxígeno de nuestro organismo se utiliza en la biosíntesis de muchos compuestos de la cadena metabólica. El oxígeno puede convertir algunas moléculas solubles en grasa en solubles en agua para su excreción.