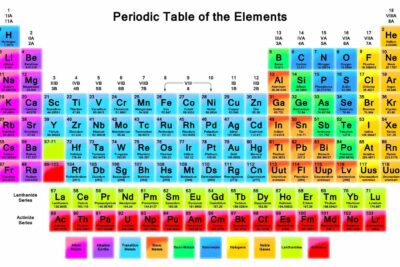
El cloro (símbolo del elemento Cl) es un elemento que se encuentra todos los días y es esencial para la vida. El cloro es de número atómico 17 con el símbolo de elemento Cl. Es importante conocer a qué grupo pertenece el cloro en la tabla periódica para comprender su comportamiento químico y su reactividad.
Datos rápidos: Cloro
- Símbolo: Cl
- Número Atómico: 17
- Apariencia: Gas amarillo verdoso
- Peso Atómico: 35.45
- Grupo: Grupo 17 (halógeno) - a este grupo pertenece el cloro
- Período: Período 3
- Configuración Electrónica: [Ne] 3s2 3p5
- Descubrimiento: Carl Wilhelm Scheele (1774)
Datos sobre el Cloro
- El cloro pertenece al grupo de elementos halógenos. Es el segundo halógeno más ligero, después del flúor. Al igual que otros halógenos, es un elemento extremadamente reactivo que forma fácilmente el anión -1. Debido a su alta reactividad, el cloro se encuentra en los compuestos. El cloro libre es raro, pero existe como un gas denso y diatómico.
- Aunque los compuestos de cloro han sido utilizados por el hombre desde la antigüedad, el cloro puro no se produjo (a propósito) hasta 1774, cuando Carl Wilhelm Scheele hizo reaccionar dióxido de magnesio con spiritus salis (ahora conocido como ácido clorhídrico)para formar cloro gaseoso. Scheele no reconoció este gas como un elemento nuevo, sino que creyó que contenía oxígeno. No fue hasta 1811 que Sir Humphry Davy determinó que el gas era, de hecho, un elemento y a qué grupo pertenece cloro en la tabla periódica, que no había sido identificado previamente. Davy le dio su nombre al cloro.
- El cloro puro es un gas o líquido de color amarillo verdoso con un olor distintivo (como el blanqueador con cloro). El nombre del elemento proviene de su color. La palabra griega clorós significa amarillo verdoso.
- El cloro es el tercer elemento más abundante en el océano (alrededor del 1,9% en masa) y el 21 elemento más abundante en la corteza terrestre.
- Hay tanto cloro en los océanos de la Tierra que pesaría 5 veces más que nuestra atmósfera actual si de alguna manera se liberara repentinamente como un gas.
- El cloro es esencial para los organismos vivos. En el cuerpo humano, se encuentra como ion cloruro, donde regula la presión osmótica y el pH y ayuda a la digestión en el estómago. El elemento generalmente se obtiene al comer sal, que es cloruro de sodio (NaCl). Si bien es necesario para la supervivencia, el cloro puro es extremadamente tóxico. El gas irrita el sistema respiratorio, la piel y los ojos. La exposición a 1 parte por mil en el aire puede causar la muerte. Dado que muchos productos químicos domésticos contienen compuestos de cloro, es arriesgado mezclarlos porque se pueden liberar gases tóxicos. En particular, es importante evitar mezclar blanqueador de cloro con vinagre, amoníaco, alcohol o acetona.
- Debido a que el cloro gaseoso es tóxico y porque es más pesado que el aire, se usó como arma química. El primer uso fue en 1915 por los alemanes en la Primera Guerra Mundial. Más tarde, el gas también fue utilizado por los Aliados Occidentales. La efectividad del gas era limitada porque su fuerte olor y color distintivo alertaban a las tropas de su presencia. Los soldados podían protegerse del gas buscando un terreno más alto y respirando a través de un paño húmedo, ya que el cloro se disuelve en el agua.
- El cloro puro se obtiene principalmente por electrólisis de agua salada. El cloro se usa para hacer que el agua potable sea segura, para blanquear, desinfectar, procesar textiles y para fabricar numerosos compuestos. Los compuestos incluyen cloratos, cloroformo, caucho sintético, tetracloruro de carbono y cloruro de polivinilo. Los compuestos de cloro se usan en medicamentos, plásticos, antisépticos, insecticidas, alimentos, pinturas, solventes y muchos otros productos. Si bien el cloro todavía se usa en refrigerantes, la cantidad de clorofluorocarbonos (CFC) liberados al medio ambiente ha disminuido drásticamente. Se cree que estos compuestos han contribuido significativamente a la destrucción de la capa de ozono.
- El cloro natural consta de dos isótopos estables: cloro-35 y cloro-37. El cloro-35 representa el 76% de la abundancia natural del elemento, y el cloro-37 constituye el otro 24% del elemento. Se han producido numerosos isótopos radiactivos de cloro.
- La primera reacción en cadena que se descubrió fue una reacción química que involucraba cloro, no una reacción nuclear, como era de esperar. En 1913, Max Bodenstein observó que una mezcla de gas cloro y gas hidrógeno explotaba al exponerse a la luz. Walther Nernst explicó el mecanismo de reacción en cadena para este fenómeno en 1918. El cloro se produce en las estrellas a través de los procesos de quema de oxígeno y silicio.
Lectura relacionada:
 ¿Qué Son los Lípidos y Qué Hacen?
¿Qué Son los Lípidos y Qué Hacen?
Fuentes
- Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Weast, Robert (1984). CRC, Manual de Química y Física. Boca Ratón, Florida: Publicación de Chemical Rubber Company. pp. E110. ISBN 0-8493-0464-4.
- Weeks, Mary Elvira (1932). "El descubrimiento de los elementos. XVII.La familia de los halógenos". Revista de Educación Química. 9 (11): 1915. doi: 10.1021 / ed009p1915
- Winder, Chris (2001). "La toxicología del cloro". Investigación Medioambiental. 85 (2): 105–14. doi:10.1006/enrs.2000.4110
 El hielo y la Densidad del Agua
El hielo y la Densidad del Agua