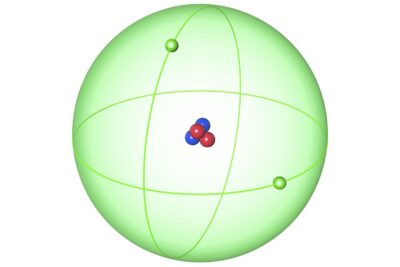
El helio es el segundo elemento con número atómico 2 en la tabla periódica. Cada átomo de helio tiene 2 protones en su núcleo atómico. El peso atómico del elemento es 4,0026. El helio no forma fácilmente compuestos, por lo que se conoce en su forma pura como gas.
Datos rápidos: Número atómico 2
- Nombre del elemento: Helio
- Símbolo del Elemento: He
- Número atómico: 2
- Peso atómico: 4.002
- Clasificación: Gas noble
- Estado de la materia: Gas
- Nombrado por: Helios, el Titán griego del Sol
- Descubierto Por: Pierre Janssen, Norman Lockyer (1868)
Datos Interesantes sobre el Segundo Elemento con Número Atómico 2
- El elemento lleva el nombre del dios griego del sol, Helios, porque se observó inicialmente en una línea espectral amarilla no identificada previamente durante el eclipse solar de 1868. Dos científicos observaron la línea espectral durante este eclipse: Jules Janssen (Francia) y Norman Lockyer (Gran Bretaña). Los astrónomos comparten el crédito por el descubrimiento del segundo elemento con número atómico 2.
- La observación directa del elemento no se produjo hasta 1895, cuando los químicos suecos Per Teodor Cleve y Nils Abraham Langlet identificaron emanaciones de helio de la cleveita, un tipo de mineral de uranio.
- Un átomo de helio típico contiene 2 protones, 2 neutrones y 2 electrones. Sin embargo, el número atómico 2 puede existir sin electrones, formando lo que se llama una partícula alfa. Una partícula alfa tiene una carga eléctrica de 2+ y se emite durante la desintegración alfa.
- El isótopo que contiene 2 protones y 2 neutrones se llama helio-4. Hay nueve isótopos de helio, pero solo el helio-3 y el helio-4 son estables. En la atmósfera, hay un átomo de helio-3 por cada millón de átomos de helio-4. A diferencia de la mayoría de los elementos, la composición isotópica del helio depende en gran medida de su fuente. Por lo tanto, el peso atómico promedio puede no aplicarse realmente a una muestra dada. La mayor parte del helio-3 encontrado hoy estaba presente en el momento de la formación de la Tierra.
- A temperatura y presión normales, el helio es un gas incoloro extremadamente ligero.
- El helio es uno de los gases nobles o gases inertes, lo que significa que tiene una capa de valencia de electrones completa, por lo que no es reactivo. A diferencia del gas de número atómico 1 (hidrógeno), el gas helio existe como partículas monoatómicas. Los dos gases tienen masa comparable (H2 y Él). Los átomos de helio individuales son tan pequeños que pasan entre muchas otras moléculas. Esta es la razón por la que un globo de helio lleno se desinfla con el tiempo: el helio escapa a través de pequeños poros en el material.
- El número atómico 2 es el segundo elemento más abundante en el universo, después del hidrógeno. Sin embargo, el elemento es raro en la Tierra (5,2 ppm en volumen en la atmósfera) porque el helio no reactivo es lo suficientemente ligero como para escapar de la gravedad de la Tierra y perderse en el espacio. Algunos tipos de gas natural, como el de Texas y Kansas, contienen helio. La fuente primaria del elemento en la Tierra es la licuefacción del gas natural. El mayor proveedor de gas es Estados Unidos. La fuente de helio es un recurso no renovable, por lo que puede llegar un momento en que nos quedemos sin una fuente práctica para este elemento.
- El segundo elemento con número atómico 2 se usa para globos de fiesta, pero su uso principal es en la industria criogénica para enfriar imanes superconductores. El principal uso comercial del helio es para escáneres de resonancia magnética. El elemento también se usa como gas de purga, para hacer crecer obleas de silicio y otros cristales, y como gas protector para soldadura. El helio se utiliza para la investigación de la superconductividad y el comportamiento de la materia a una temperatura cercana al cero absoluto.
- Una propiedad distintiva del número atómico 2 es que este elemento no puede congelarse en forma sólida a menos que esté presurizado. El helio permanece líquido hasta el cero absoluto a presión normal, formando un sólido a temperaturas entre 1 K y 1,5 K y 2,5 MPa de presión. Se ha observado que el helio sólido posee una estructura cristalina.
Lectura relacionada:
 Modelo básico del Átomo
Modelo básico del Átomo
Fuentes
- Hammond, C. R. (2004). Los Elementos, en Manual de Química y Física (81a ed.). Prensa CRC. ISBN 978-0-8493-0485-9.
- Hampel, Clifford A. (1968). Enciclopedia de los Elementos Químicos. Nueva York: Van Nostrand Reinhold. pp.256-268.
- Meija, J.; et al. (2016). "Pesos atómicos de los elementos 2013 (Informe Técnico de la IUPAC)". Química Pura y Aplicada. 88 (3): 265–91.
- Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). "Gases nobles". Enciclopedia Kirk Othmer de Tecnología Química. Wiley. pp.343-383.
- Weast, Robert (1984). CRC, Manual de Química y Física. Boca Ratón, Florida: Publicación de Chemical Rubber Company. pp. E110.
 Definición Limitante de Reactivos en Química
Definición Limitante de Reactivos en Química