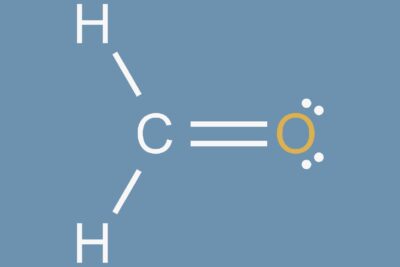
Las dos clases principales de moléculas son moléculas polares y moléculas no polares. Algunas moléculas son claramente polares o no polares, mientras que otras caen en algún lugar del espectro entre dos clases. Aquí hay un vistazo a lo que significan polar y no polar, cómo predecir si una molécula será una u otra, y ejemplos de compuestos representativos.
Conclusiones clave: Polar y No polar
- En química, la polaridad se refiere a la distribución de la carga eléctrica alrededor de átomos, grupos químicos o moléculas.
- Las moléculas polares se producen cuando hay una diferencia de electronegatividad entre los átomos unidos.
- Las moléculas no polares se producen cuando los electrones se comparten por igual entre los átomos de una molécula diatómica o cuando los enlaces polares en una molécula más grande se anulan entre sí.
Moléculas Polares
Las moléculas polares se producen cuando dos átomos no comparten electrones por igual en un enlace covalente. Se forma un dipolo, con una parte de la molécula que lleva una ligera carga positiva y la otra parte que lleva una ligera carga negativa. Esto sucede cuando hay una diferencia entre los valores de electronegatividad de cada átomo. Una diferencia extrema forma un enlace iónico, mientras que una diferencia menor forma un enlace covalente polar. Afortunadamente, puede buscar electronegatividad en una tabla para predecir si es probable que los átomos formen enlaces covalentes polares o no. Si la diferencia de electronegatividad entre los dos átomos está entre 0,5 y 2,0, los átomos forman un enlace covalente polar. Si la diferencia de electronegatividad entre los átomos es mayor que 2,0, el enlace es iónico. Los compuestos iónicos son moléculas extremadamente polares.
Lectura relacionada: Datos del rubidio-Rb o Elemento 37
Datos del rubidio-Rb o Elemento 37
Ejemplos de moléculas polares incluyen:
- Agua-H2O
- Amoníaco-NH3
- Dióxido de azufre - SO2
- Sulfuro de hidrógeno-H2S
- Etanol-C2H6O
Obsérvese que los compuestos iónicos, tales como el cloruro de sodio (NaCl), son polares. Sin embargo, la mayoría de las veces, cuando las personas hablan de "moléculas polares", se refieren a" moléculas covalentes polares " y no a todos los tipos de compuestos con polaridad. Al referirse a la polaridad de los compuestos, es mejor evitar la confusión y llamarlos no polares, covalentes polares e iónicos.
Lectura relacionada:
 Cómo Funciona el Esmalte de Uñas y De Qué Está Hecho
Cómo Funciona el Esmalte de Uñas y De Qué Está HechoMoléculas No Polares
Cuando las moléculas comparten electrones por igual en un enlace covalente, no hay carga eléctrica neta a través de la molécula. En un enlace covalente no polar, los electrones se distribuyen uniformemente. Puedes predecir que se formarán moléculas no polares cuando los átomos tengan la misma electronegatividad o una similar. En general, si la diferencia de electronegatividad entre dos átomos es inferior a 0,5, el enlace se considera no polar, aunque las únicas moléculas verdaderamente no polares son las formadas con átomos idénticos.
Las moléculas no polares también se forman cuando los átomos que comparten un enlace polar se disponen de tal manera que las cargas eléctricas se cancelan entre sí.
Ejemplos de moléculas no polares incluyen:
Lectura relacionada: Definición de Mezcla Heterogénea Con Ejemplos
Definición de Mezcla Heterogénea Con Ejemplos- Cualquiera de los gases nobles: He, Ne, Ar, Kr, Xe (Estos son átomos, no técnicamente moléculas.)
- Cualquiera de los elementos diatómicos homonucleares: H2, N2, O2, Cl2 (Estas son moléculas verdaderamente no polares.)
- Dióxido de carbono-CO2
- Benceno-C6H6
- Tetracloruro de carbono - CCl4
- Metano-CH4
- Etileno-C2H4
- Líquidos de hidrocarburos, como gasolina y tolueno
- La mayoría de las moléculas orgánicas
Soluciones de Polaridad y Mezcla
Si conoce la polaridad de las moléculas, puede predecir si se mezclarán o no para formar soluciones químicas. La regla general es que" lo similar se disuelve en lo similar", lo que significa que las moléculas polares se disolverán en otros líquidos polares y las moléculas no polares se disolverán en líquidos no polares. Esta es la razón por la que el aceite y el agua no se mezclan: el aceite no es polar mientras que el agua es polar.
Es útil saber qué compuestos son intermedios entre polares y no polares porque puede usarlos como intermedios para disolver un químico en uno con el que no se mezclaría de otra manera. Por ejemplo, si desea mezclar un compuesto iónico o un compuesto polar en un solvente orgánico, es posible que pueda disolverlo en etanol (polar, pero no por mucho). Luego, puede disolver la solución de etanol en un solvente orgánico, como xileno.
Fuentes
- Ingold, C. K.; Ingold, E. H. (1926). "La Naturaleza del Efecto Alterno en las Cadenas de Carbono. Parte V. Una Discusión de la Sustitución Aromática con Especial Referencia a los Roles Respectivos de la Disociación Polar y No Polar; y un Estudio Adicional de las Eficiencias Directivas Relativas del Oxígeno y el Nitrógeno". J. Chem. Soc.: 1310–1328. doi: 10.1039 / jr9262901310
- Pauling, L. (1960). La Naturaleza del Enlace Químico (3ª ed.). Oxford University Press. pp.98-100. ISBN 0801403332.
- Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (1 de noviembre de 2000). "Deflexión Eléctrica de Corrientes Líquidas Polares: Una Demostración Incomprendida". Revista de Educación Química. 77 (11): 1520. doi: 10.1021 / ed077p1520