
¿Qué es el Escandio?
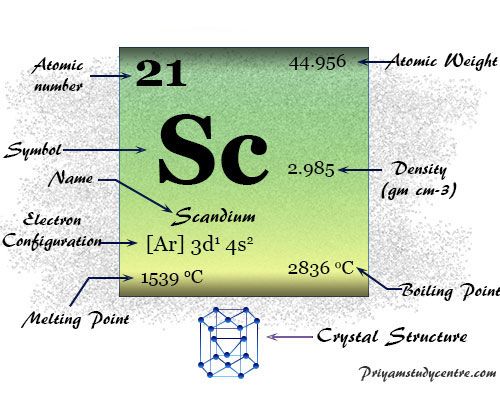
Escandio es un elemento químico o metal de transición del grupo 3 de la tabla periódica con número atómico 21 y símbolo Sc. El número de oxidación general o estado del escandio es +3 debido a la presencia de tres electrones de valencia.
Sc es un metal blanco plateado, moderadamente blando. Por lo general, ocurre con los lantánidos debido a la falta de características de metales de transición.
Lectura relacionada: Aluminio, propiedades, descubrimiento, uso, conexiones.
Aluminio, propiedades, descubrimiento, uso, conexiones.La química del escandio es similar a la del aluminio metálico. Por eso, el químico ruso Dmitry Ivanovich Mendeleyev lo llamó ekaboron.
¿Dónde se encuentra el escandio?
Es el 50º elemento más abundante en el entorno terrestre y el 23º elemento más abundante en el Sol debido a su alta abundancia cósmica.
En la corteza terrestre, el escandio no es raro, se encuentra con los lantánidos y el mineral de uranio (0,02 por ciento de Sc2O3) que puede obtenerse como subproducto. Thortveitita (Sc2SiO7) es un mineral de escandio que se encuentra principalmente en Noruega.
Lectura relacionada: Titanio, Símbolo, Propiedades, Hechos, Conexiones, Uso
Titanio, Símbolo, Propiedades, Hechos, Conexiones, UsoEscandio en la tabla periódica
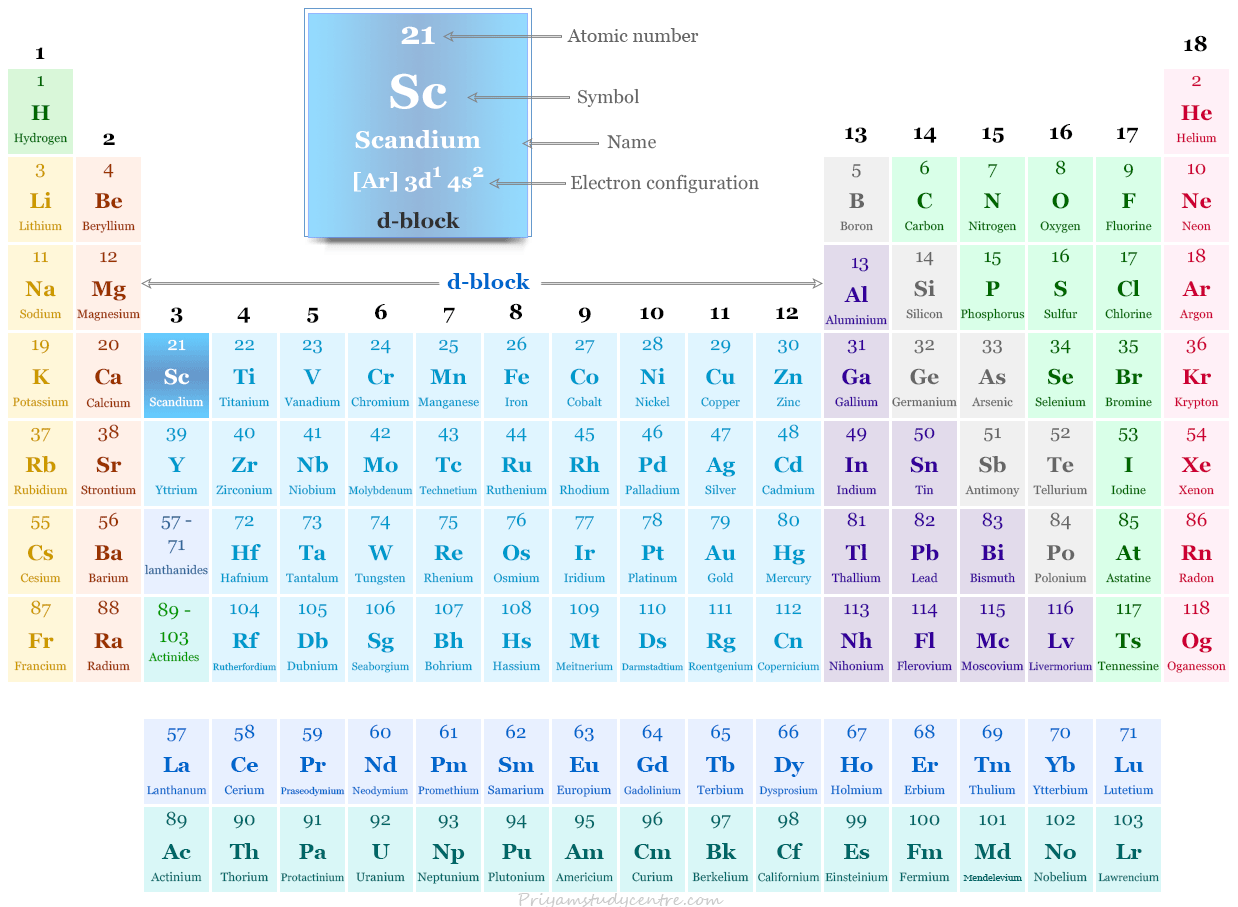
El escandio, el itrio y el lantano forman el grupo 3 de la tabla periódica. Son los miembros iniciales de las tres primeras series de transición. tienen publicidad1 s2 configuración electrónica sobre envolvente cerrada de gas noble.
 Oro, Hechos, Uso, Propiedades, Procesamiento
Oro, Hechos, Uso, Propiedades, ProcesamientoPropiedades del escandio
La red cristalina hexagonal blanca plateada, Sc tiene la configuración electrónica de la escala de valencia [Ar] 3d1 4s2. El número de oxidación general o estado del metal es +3 sin electrón d.
Algunas propiedades físicas y químicas del escandio se dan debajo de la tabla,
| Escandio | |||
| Símbolo | Carolina del Sur | ||
| Descubrimiento | Lars Frederick Nilson en 1879 | ||
| Nombre derivado de | De Scandia, el nombre latino de Escandinavia. | ||
| isótopo común | 45Carolina del Sur | ||
| Estados de oxidación | 0, +1, +2, +3 | ||
| número CAS | 7440-20-2 | ||
| Propiedades periódicas | |||
| número atómico | 21 | ||
| Masa atómica relativa | 44.956 | ||
| electrón por celda | 2, 8, 9, 2 | ||
| Configuración electrónica | [Ar] 3d1 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 3 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1541°C, 2806°F, 1814K | ||
| Punto de ebullición | 2836°C, 5137°F, 3109K | ||
| Capacidad calorífica molar | 16.443 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 25,52 g/cm23 | ||
| Calor de fusión | 14,1 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.15 | ||
| Radio covalente | 1.59 | ||
| electronegatividad | 1,36 (escala de Pauling) | ||
| Afinidad electronica | 18,139 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 633.09 | 1234.99 | 2388.65 | |
Proceso de producción
Los minerales de escandio se pueden tratar de la misma manera que la bauxita para obtener ScO(OH) insoluble y la deshidratación del óxido hidratado para formar Sc2O3.
El metal se obtiene por electrólisis de una mezcla fundida de tricloruro de escandio (ScCl3), cloruro de potasio (KCl) y cloruro de litio (LiCl).
Isótopos del elemento
En naturaleza, 45Sc es el isótopo más estable del escandio. También tiene trece isótopos radiactivos inestables de vida corta con masas atómicas que van desde 36 a 61.
46Sc es el isótopo radiactivo más estable (vida media de 83,8 días) y 39Sc es el isótopo menos estable con una vida media de menos de 300 nanosegundos.
Principalmente, los isótopos de calcio o titanio se forman por la descomposición radiactiva de los isótopos de escandio. Masa atómica por debajo de 46 formada principalmente por isótopos de calcio y por encima de 46 isótopos de titanio formados por reacción nuclear.
Datos sobre el escandio
- La química y los hechos del escandio son muy similares al elemento aluminio. Ambos metales están dominados por el estado +3 o forman iones trivalentes como Al+3 y SC+3.
- Sc es menos electropositivo que el calcio del miembro del grupo anterior.
- Es un elemento de transición debido a la presencia de un electrón ad. Pero no muchas de las propiedades (número de oxidación variable) asociadas con Sc. Por lo tanto, se comporta más como metales que no son de transición.
- Sc se disuelve tanto en ácidos como en álcalis, pero no reacciona con la mezcla 1:1 de ácidos nítrico y fluorhídrico para formar capas protectoras.
- El nitrógeno se combina con él a altas temperaturas para formar ScN, que se forma por agua tras la hidrólisis.
Ingredientes químicos
haluro de escandio
Los halógenos como el flúor, el cloro y el bromo reaccionan con el escandio para formar haluros iónicos (ScX3). ScF3 es el único haluro insoluble que se disuelve en fluoruro de amonio o fluoruro de metal alcalino para dar octaédrico [ScF6]−3 iones
El tricloruro como ScCl3 es isoestructural con AlCl3. Respuesta de ScCl.3 con exceso de Sc a alta temperatura da una estructura de capa que contiene haluros inferiores (ScCl).
Óxido de escandio
El óxido Sc(III) o scandia es un óxido de metal con la fórmula química Sc2O3. Es de naturaleza anfótera. Carolina del Sur2O3 se disuelve en ácidos para dar sales Sc(III). En exceso de hidróxido de sodio da Na3[Sc(OH)6]−3.
usando escandio
- La aleación de escandio es fuerte como el titanio y liviana como el aluminio y se utiliza para fabricar componentes aeroespaciales, equipos deportivos, materiales de alto rendimiento para bates de béisbol y cuadros de bicicletas.
- La aleación se utiliza en aviones militares rusos como el MIG-21 y el MiG-29.
- Los isótopos radiactivos 46Sc utilizado como trazador en el proceso de refinación de petróleo.
- Es ampliamente utilizado en la industria de la televisión.
- En los Estados Unidos y las principales provincias industriales, las lámparas de haluro de escandio se utilizan para producir luz altamente eficiente, como la luz solar.












