Yodo
Yodo es un elemento químico del Grupo 17 (VIIA) de la tabla periódica. Es un miembro de la familia de los halógenos con número atómico 17 y símbolo I. Es ampliamente utilizado en la producción de muchos compuestos orgánicos comunes como el yodoformo (CHI3) y yoduro de metilo (CH3L).
Es el miembro estable y más pesado de la familia de los halógenos, situado entre el flúor, el cloro y el bromo.
Lectura relacionada: Radon, Hechos, Símbolo, Propiedades, Efectos, Uso
Radon, Hechos, Símbolo, Propiedades, Efectos, UsoEl yodo, elemento esencial, se usa en nuestro cuerpo para producir hormonas tiroideas para regular el metabolismo y muchas otras funciones biológicas importantes.
¿Quién descubrió el yodo?
El yodo fue descubierto en 1811 por el químico francés Bernard Courtois. El nombre del elemento propuesto por Joseph Louis Gay-Lussac de la palabra griega ioeides que significa color violeta.
Yodo en la tabla periódica
Se coloca en el grupo 17 y el período 5 en la tabla periódica. Es un miembro de la familia de los halógenos que se encuentra entre el bromo y el astato.
Lectura relacionada: Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso
Cripton, Elemento, Descubrimiento, Propiedades, Hechos, Uso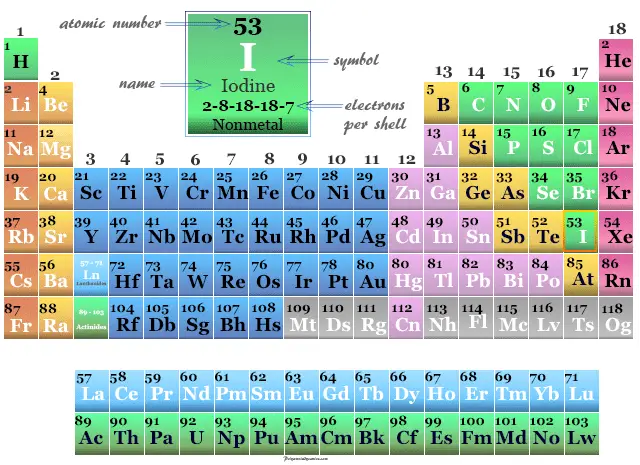
Propiedades del yodo
El elemento químico no metálico, el yodo, tiene una configuración electrónica [Kr] 4d10 5s2 5p5. Excepto el flúor, todos los halógenos exhiben diferentes estados o números de oxidación positivos en sus óxidos, oxoácidos y compuestos interhalógenos.
Lectura relacionada: Neon, Propiedades, Uso, Conexiones, Hechos
Neon, Propiedades, Uso, Conexiones, HechosCationes poliatómicos X2+ y X3+ son conocidos por el yodo. Algunas propiedades del elemento se dan debajo de la tabla,
| Yodo | |||
| Símbolo | yo | ||
| Fórmula molecular | yo2 | ||
| Descubrimiento | Bernardo Courtois en 1811 | ||
| Nombre derivado de | la palabra griega iodes que significa violeta | ||
| isótopo común | 127yo | ||
| Estados de oxidación | −1, +1, +3+4, +5+6, +7 | ||
| número CAS | 7553-56-2 | ||
| Propiedades periódicas | |||
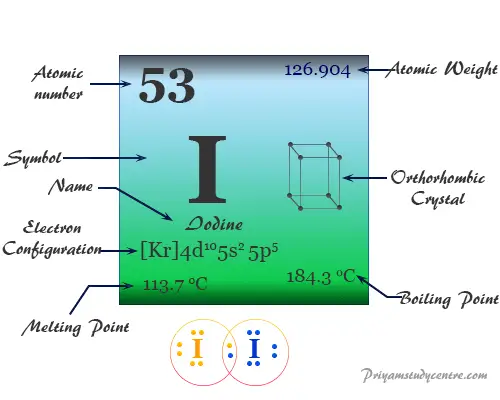
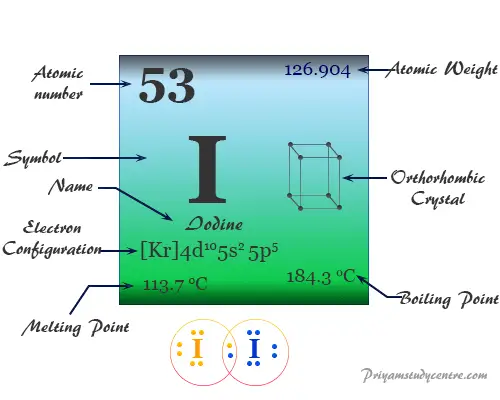
| número atómico | 53 | ||
| Masa atómica relativa | 126.904 | ||
| electrón por celda | 2, 8, 18, 18, 7 | ||
| Configuración electrónica | [Kr] 4d10 5s2 5p5 | ||
| Bloquear | bloque p | ||
| Grupo | 17 | ||
| Período de tiempo | 5 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 113,7°C, 236,7°F, 386,9K | ||
| Punto de ebullición | 184,4 °C, 363,9 °F, 457,6 K | ||
| Capacidad calorífica molar | 54,44 J mol−1 k1 | ||
| estructura cristalina | ortorrómbico centrado en la cara | ||
| Espesor | 4,933 g/cm3 | ||
| Temperatura crítica | 819K | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.98 | ||
| Radio covalente | 1.36 | ||
| Electronegatividad | 2,66 (escala de Pauling) | ||
| Afinidad electronica | 295.152 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 1008.39 | 1845.89 | 3184 | |
Fuentes de yodo
Es menos abundante en el grupo de los halógenos, solo 0,46 ppm (61° orden). El cerebro contiene iones de yoduro hasta 100 ppm.
El agua del océano contiene I2 molécula a 0,05 ppm, pero ciertos animales marinos como Laminaria y Fucus pueden concentrarla a 0,45 por ciento de su peso seco.
isótopos
El yodo tiene treinta y siete isótopos conocidos, pero solo un isótopo natural estable como el 127I. Los otros son isótopos radiactivos con una vida media muy corta.
La descomposición radiactiva del I-131 se usa en medicina nuclear y radioterapia para el diagnóstico y tratamiento de enfermedades de la tiroides.
producción de yodo
Dependiendo de las fuentes, puede ser producido por diferentes tipos de procesos. En los Estados Unidos y Japón, las salmueras naturales que contienen yoduros se pueden clorar para generar gas yodo. El gas fue barrido por el aire y purificado por sublimación.
En otro método, el yoduro es precipitado por la solución de nitrato de plata.
- El yoduro de plata precipitado (AgI) se trata con polvo de hierro para formar plata metálica y FeI.2.
- La plata libre se trató con ácido nítrico para su reutilización en el proceso.
- El yoduro de hierro (FeI2) la solución se clora para formar yodo, absorbido por carbón activado o resina de intercambio iónico.
Yodo de algas
Las algas se recolectan, se secan y se gravan. La ceniza se trata con agua y yoduro soluble separado de otros materiales insolubles. La solución se concentra para cristalizar otras sales solubles.
El filtrado final se destila con ácido sulfúrico y dióxido de manganeso en una planta de producción de yodo de hierro fundido.
Datos sobre el yodo
El yodo tiene una configuración electrónica. [Kr] 4d10 5s2 5p5, con siete electrones en la última capa cuántica. Al igual que otros halógenos, también tiene un electrón por debajo del siguiente gas noble.
La configuración de gas noble se logra tomando un electrón de un ambiente reactivo o compartiendo electrones por enlace covalente. La molécula de yodo se forma por enlace químico covalente con la fórmula molecular I2.
El yodo es el agente oxidante más débil de todos los halógenos estables debido a su baja energía de ionización y baja afinidad electrónica. Por otro lado, el flúor es el elemento químicamente más reactivo o halógeno debido a su electronegatividad y baja energía de enlace.
El flúor combina directamente la mayoría de los metales y no metales. Algunos metales como el hierro, el cobre, el níquel y el aluminio forman una capa protectora de iones de fluoruro que evita una reacción posterior.
El átomo de yodo tiende a formar compuestos en los que está presente como catión para exhibir propiedades básicas. Por ejemplo ICl, IBr, INO3yo2ASI QUE4yo (CH3ARRULLO)3etc.
Color de los halógenos
El color del halógeno muestra interesantes gradaciones de amarillo pálido (flúor), amarillo verdoso (cloro), marrón rojizo (bromo). El color de las moléculas gaseosas de halógeno diatómico surge de la absorción de radiación ultravioleta visible para el π → transición.
La separación entre los dos niveles disminuye desde la F2 a mi2 molécula que cambia la absorción a frecuencias más bajas.
La molécula de yodo emite fuertemente en la región violeta que no cambia al disolver muchos solventes orgánicos como los hidrocarburos y el tetracloruro de carbono.
Ingredientes químicos
El yodo es el halógeno menos reactivo y estable, pero sigue siendo reactivo entre los elementos de la tabla periódica. El efecto del aumento de tamaño entre los halógenos, el yodo, muestra una tendencia a lograr una mayor covalencia y número de coordinación.
Por ejemplo, solo se forma SI7 mientras que el cloro y el bromo no van más allá de ClF3 y BrF5 respectivamente.
yoduro de hidrogeno
Todo el halógeno reacciona con el hidrógeno para formar hidruros covalentes volátiles. La reactividad hacia el hidrógeno disminuye gradualmente de flúor a yodo.
El yoduro de hidrógeno se obtiene tratando una mezcla de agua y fósforo rojo con yodo. Los hidruros HCl, HBr y HI son gases a temperatura ordinaria, pero el HF es líquido debido a su asociación a través de puentes de hidrógeno.
Todos los hidruros se ionizan en solución acuosa por solvatación. La energía de disociación de enlaces más débiles convierte a los tres ácidos hídricos, como HCl, HBr y HI, en ácidos fuertes con una escala de pH baja.
compuestos de yoduro
Casi todos los elementos de la tabla periódica, excepto el helio, el neón y el argón, forman compuestos binarios con yodo para dar una amplia variedad de yoduros.
Los elementos como el oxígeno, el nitrógeno, el flúor, el cloro y el bromo tienen una electronegatividad mayor que la del yodo. Por lo tanto, los compuestos binarios de tales elementos no se denominan yoduro, sino óxidos, nitruros, fluoruros, cloruros y bromuros.
La mayoría de los yoduros metálicos tienen compuestos iónicos, pero el carácter covalente parcial se desarrolla según la carga y el estado de oxidación del metal. El yoduro no metálico tiende a formarse por enlace covalente.
Óxidos
Los óxidos de halógeno son compuestos inestables y los óxidos superiores son más estables que los inferiores. Los óxidos de yodo son los más estables de todos los óxidos de halógeno.
yo2O5 es el óxido más estable pero óxidos relativamente menos estables como I2O4 y yo4O9 también formado por moléculas de yodo. yo2O5 es un sólido higroscópico, se disuelve en agua para formar HIO. Dar forma3.
Oxoácidos de yodo
La estabilidad de los oxoácidos y sus aniones en una solución acuosa está determinada por reacciones redox, junto con influencias cinéticas significativas.
Ácido yódico (HIO3) es un importante oxoácido de yodo formado al hervir yodo con diez veces su peso de ácido nítrico fumante.
El yodato de potasio sólido cristalino fue preparado por I. calentar2 con una solución concentrada de KClO3 en presencia de pequeños HNO3. Es un buen oxidante utilizado en muchas valoraciones oxidimétricas.
Al igual que el antimonio y el telurio, también tiende a alcanzar números de coordinación más altos y formas H5IO6.
¿Para qué sirve el yodo?
La producción mundial de yodo es de unas 16.000 toneladas al año, siendo Japón solo casi la mitad. La mitad del yodo se utiliza en la producción de diversos compuestos orgánicos como el yodoformo (antiséptico) y el yoduro de metilo.
Otros usos comunes del yodo y sus compuestos se dan a continuación,
- El yodo y sus compuestos se utilizan ampliamente en suplementos alimenticios para animales, colorantes, medicamentos, saneamiento
- Es un inhibidor de la contaminación como el smog.
- Se utiliza para la purificación de metales como titanio, zirconio y hafnio.
- En fotografía, el yoduro de plata se usa en fotografía de alta velocidad.
- Varios compuestos inorgánicos que contienen yodo se utilizan como catalizadores químicos en la industria del caucho, en colorantes y para muchos otros fines analíticos.
- La molécula de yodo también se utiliza en el análisis del espectro electromagnético estándar secundario debido a sus líneas espectrales nítidas con un rango de longitud de onda de 500-700nm.
- Yoduro de sodio (NaI) y NaIO3 se agregan a la sal de mesa para reponer una deficiencia de yodo en nuestros cuerpos, lo que puede dificultar la producción de tiroxina, una hormona reguladora del crecimiento.