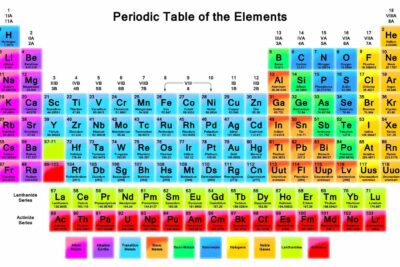
Cómo Leer la Tabla Periódica de los Elementos
Haga clic en el símbolo de un elemento para obtener información detallada sobre cada elemento químico. El símbolo de elemento es una abreviatura de una o dos letras para el nombre de un elemento.
El número entero sobre el símbolo del elemento es su número atómico. El número atómico es el número de protones en cada átomo de ese elemento. El número de electrones puede cambiar, formando iones, o el número de neutrones puede cambiar, formando isótopos, pero el número de protones define el elemento. La tabla periódica moderna ordena el elemento aumentando el número atómico. La tabla periódica de Mendeleev era similar, pero las partes del átomo no se conocían en su época, por lo que organizó los elementos aumentando el peso atómico.
Lectura relacionada: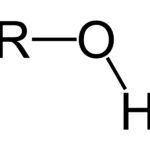 ¿Cómo Se Llama el Grupo Funcional OH?
¿Cómo Se Llama el Grupo Funcional OH?
El número debajo del símbolo del elemento se llama masa atómica o peso atómico. Es la suma de la masa de protones y neutrones en un átomo (los electrones contribuyen con una masa insignificante), pero puede notar que no es el valor que obtendría si asumiera que el átomo tiene el mismo número de protones y neutrones. Los valores de peso atómico pueden ser diferentes de una tabla periódica a otra porque es un número calculado, basado en el promedio ponderado de los isótopos naturales de un elemento. Si se descubre un nuevo suministro de un elemento, la proporción de isótopos puede ser diferente de lo que los científicos creían anteriormente. Entonces, el número puede cambiar. Tenga en cuenta que si tiene una muestra de un isótopo puro de un elemento, la masa atómica es simplemente la suma del número de protones y neutrones de ese isótopo.
Grupos de Elementos y Períodos de Elementos
La tabla periódica recibe su nombre porque ordena los elementos de acuerdo con propiedades recurrentes o periódicas. Los grupos y períodos de la tabla organizan los elementos de acuerdo con estas tendencias. Incluso si no supieras nada sobre un elemento, si supieras sobre uno de los otros elementos en su grupo o período, podrías hacer predicciones sobre su comportamiento.
Lectura relacionada: Definición de Número Atómico - Glosario de Química
Definición de Número Atómico - Glosario de Química
Grupos
La mayoría de las tablas periódicas están codificadas por colores para que pueda ver de un vistazo qué elementos comparten propiedades comunes entre sí. A veces, estos grupos de elementos (por ejemplo, metales alcalinos, metales de transición, no metales) se denominan grupos de elementos, pero también escuchará a los químicos referirse a las columnas (que se mueven de arriba a abajo) de la tabla periódica llamadas grupos de elementos. Los elementos en la misma columna (grupo) tienen la misma estructura de capa de electrones y el mismo número de electrones de valencia. Dado que estos son los electrones que participan en las reacciones químicas, los elementos de un grupo tienden a reaccionar de manera similar.
Los números romanos enumerados en la parte superior de la tabla periódica indican el número habitual de electrones de valencia para un átomo de un elemento enumerado debajo de él. Por ejemplo, un átomo de un elemento del grupo VA tendrá típicamente 5 electrones de valencia.
Lectura relacionada: Cómo Dibujar una estructura de Lewis
Cómo Dibujar una estructura de Lewis
Períodos
Las filas de la tabla periódica se llaman períodos. Los átomos de los elementos en el mismo período tienen el mismo nivel de energía de electrones no excitados (estado fundamental) más alto. A medida que se mueve hacia abajo en la tabla periódica, el número de elementos en cada grupo aumenta porque hay más subniveles de energía de electrones por nivel.
Tendencias de la Tabla Periódica
Además de las propiedades comunes de los elementos en grupos y períodos, el gráfico organiza los elementos de acuerdo con las tendencias en el radio iónico o atómico, la electronegatividad, la energía de ionización y la afinidad electrónica.
El radio atómico es la mitad de la distancia entre dos átomos que se están tocando. El radio iónico es la mitad de la distancia entre dos iones atómicos que apenas se tocan. El radio atómico y el radio iónico aumentan a medida que se mueve hacia abajo en un grupo de elementos y disminuyen a medida que se mueve a través de un período de izquierda a derecha.
La electronegatividad es la facilidad con la que un átomo atrae electrones para formar un enlace químico. Cuanto mayor es su valor, mayor es la atracción por los electrones de enlace. La electronegatividad disminuye a medida que se mueve hacia abajo en un grupo de la tabla periódica y aumenta a medida que se mueve a través de un período.
La energía necesaria para eliminar un electrón de un átomo gaseoso o ion atómico es su energía de ionización. La energía de ionización disminuye al moverse hacia abajo en un grupo o columna y aumenta al moverse de izquierda a derecha a través de un período o fila.
La afinidad electrónica es la facilidad con la que un átomo puede aceptar un electrón. Excepto que los gases nobles tienen una afinidad electrónica prácticamente nula, esta propiedad generalmente disminuye al moverse hacia abajo en un grupo y aumenta al moverse a lo largo de un período.
El Propósito de la Tabla Periódica
La razón por la que los químicos y otros científicos usan la tabla periódica en lugar de algún otro gráfico de información de elementos es porque la disposición de los elementos de acuerdo con las propiedades periódicas ayuda a predecir las propiedades de elementos desconocidos o no descubiertos. Puede usar la ubicación de un elemento en la tabla periódica para predecir los tipos de reacciones químicas en las que participará y si formará enlaces químicos con otros elementos o no.
Tablas Periódicas Imprimibles y Más
A veces es útil imprimir una tabla periódica, para que puedas escribir en ella o tenerla contigo en cualquier lugar. Tengo una gran colección de tablas periódicas que puedes descargar para usar en un dispositivo móvil o imprimir. También tengo una selección de cuestionarios de la tabla periódica que puede realizar para evaluar su comprensión de cómo está organizada la tabla y cómo usarla para obtener información sobre los elementos.