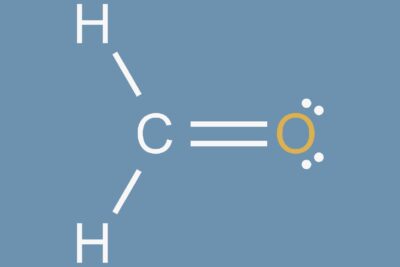
Ácido acético (CH3COOH) es el nombre común para el ácido etanoico. Es un compuesto químico orgánico que tiene un olor acre distintivo y un sabor agrio, reconocible como el aroma y el sabor del vinagre. El vinagre es aproximadamente 3-9% de ácido acético.
En Qué Se Diferencia El Ácido Acético Glacial
El ácido acético que contiene una cantidad muy baja de agua (menos del 1%) se denomina ácido acético anhidro (sin agua) o ácido acético glacial. La razón por la que se llama glacial es porque se solidifica en cristales sólidos de ácido acético justo más fríos que la temperatura ambiente a 16,7 °C. La eliminación del agua del ácido acético reduce su punto de fusión en 0,2 °C. La fórmula del ácido acético glacial es la misma que la de su forma diluida, CH3COOH, pero la pureza y concentración son clave en su estado glacial. Al hablar de su uso en laboratorio, la molaridad del ácido acético glacial es un factor importante a considerar en las reacciones químicas y la preparación de soluciones.
Lectura relacionada: Hechos del Argón (Número atómico 18 o Ar)
Hechos del Argón (Número atómico 18 o Ar)
El ácido acético glacial puede prepararse goteando una solución de ácido acético sobre una "estalactita" de ácido acético sólido (que podría considerarse congelado). Al igual que un glaciar de agua contiene agua purificada, incluso si está flotando en el mar salado, el ácido acético puro se adhiere al ácido acético glacial, mientras que las impurezas se escurren con el líquido.
Precaución: Aunque el ácido acético se considera un ácido débil, lo suficientemente seguro como para beber en vinagre, el ácido acético glacial es corrosivo y puede dañar la piel al contacto.
Lectura relacionada:
 Análisis Cualitativo: Identificación de Aniones y Cationes
Análisis Cualitativo: Identificación de Aniones y CationesMás Datos sobre el Ácido Acético
El ácido acético es uno de los ácidos carboxílicos. Es el segundo ácido carboxílico más simple, después del ácido fórmico. Los principales usos del ácido acético son en vinagre y para hacer acetato de celulosa y acetato de polivinilo. El ácido acético se usa como aditivo alimentario (E260), donde se agrega para dar sabor y acidez regular. También es un reactivo importante en química. En todo el mundo, se utilizan alrededor de 6,5 toneladas métricas de ácido acético al año, de las cuales aproximadamente 1,5 toneladas métricas al año se producen mediante reciclaje. La mayor parte del ácido acético se prepara usando materia prima petroquímica.
Denominación de Ácido Acético y Ácido Etanoico
El nombre de la IUPAC para el producto químico es ácido etanoico, un nombre formado usando la convención de dejar caer la "e" final en el nombre del alcano de la cadena de carbono más larga en el ácido (etano) y agregar la terminación "ácido-oico". Sin embargo, en la práctica común y en la nomenclatura, la abreviatura para ácido acético es AcOH, facilitando su distinción del etanol (EtOH).
Lectura relacionada: Qué es un Indicador de pH? Definición y Ejemplos
Qué es un Indicador de pH? Definición y Ejemplos
Aunque el nombre formal es ácido etanoico, la mayoría de las personas se refieren al químico como ácido acético. De hecho, la abreviatura usual para el reactivo es AcOH, en parte para evitar la confusión con EtOH, una abreviatura común para etanol. El nombre común "ácido acético" proviene de la palabra latina acetum, lo que significa vinagre.
Acidez y Uso como Disolvente
El ácido acético tiene un carácter ácido porque el centro de hidrógeno en el grupo carboxilo (-COOH) se separa mediante ionización para liberar un protón:
CH3CO2H → CH3CO2− + H+
Esto hace que el ácido acético sea un ácido monoprótico con un valor de pKa de 4,76 en solución acuosa. La concentración de la solución afecta en gran medida la disociación para formar el ion hidrógeno y la base conjugada, acetato (CH3COO−). A una concentración comparable a la del vinagre (1,0 M), el pH es de aproximadamente 2,4 y solo se disocia aproximadamente el 0,4 por ciento de las moléculas de ácido acético. Sin embargo, en soluciones muy diluidas, más del 90 por ciento del ácido se disocia.
El ácido acético es un disolvente ácido versátil. Como disolvente, el ácido acético es un disolvente prótico hidrófilo, muy parecido al agua o al etanol. El ácido acético disuelve compuestos polares y no polares y es miscible en disolventes polares (agua) y no polares (hexano, cloroformo). Sin embargo, el ácido acético no es completamente miscible con alcanos superiores, tales como octano. Esto destaca la importancia de conocer los usos de los alcanos, los cuales incluyen, pero no se limitan a, ser empleados como combustibles y lubricantes, en la producción de plásticos y como solventes en la industria química.
Importancia en Bioquímica
El ácido acético se ioniza para formar acetato a pH fisiológico. El grupo acetilo es esencial para toda la vida. Las bacterias del ácido acético (por ejemplo, Acetobacter y Clostridium acetobutlicum) producen ácido acético. Las frutas producen ácido acético a medida que maduran. En humanos y otros primates, el ácido acético es un componente de la lubricación vaginal, donde actúa como un agente antibacteriano. Cuando el grupo acetilo se une a la coenzima A, la holoenzima se usa en el metabolismo de grasas y carbohidratos.
Ácido acético en Medicina
El ácido acético, incluso a una concentración del 1 por ciento, es un antiséptico eficaz, utilizado para matar Enterococos, Estreptococos, Estafilococos, y Pseudomonas. El ácido acético diluido se puede usar para controlar infecciones cutáneas de bacterias antibióticas, en particular Pseudomonas. La inyección de ácido acético en los tumores ha sido un tratamiento contra el cáncer desde principios del siglo XIX.La aplicación de ácido acético diluido es un tratamiento seguro y eficaz para la otitis externa.El ácido acético también se usa como una prueba rápida de detección del cáncer de cuello uterino.El ácido acético aplicado con un hisopo en el cuello uterino se vuelve blanco en un minuto si hay cáncer presente.
Referencias Adicionales
- Fokom-Domgue, J.; Combescure, C.; Fokom-Defo, V.; Tebeu, P. M.; Vassilakos, P.; Kengne, A. P.; Petignat, P. (3 de julio de 2015). "Rendimiento de estrategias alternativas para la detección primaria del cáncer de cuello uterino en África subsahariana: revisión sistemática y metanálisis de estudios de precisión de pruebas diagnósticas". BMJ (Investigación clínica ed.). 351: h3084.
- Madhusudhan, V. L. (8 de abril de 2015). "Eficacia del ácido acético al 1% en el tratamiento de heridas crónicas infectadas con Pseudomonas aeruginosa: ensayo clínico controlado aleatorio prospectivo". Revista Internacional de Heridas. 13: 1129–1136.