La absorción y la adsorción son dos procesos que a menudo se usan indistintamente. Aunque ambos tienen similitudes, difieren en muchos aspectos. En este artículo, comprenderá la absorción y la adsorción en su propio sentido.
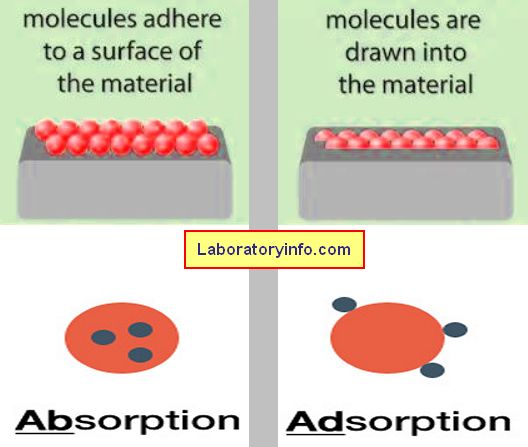
Qué es la absorción?
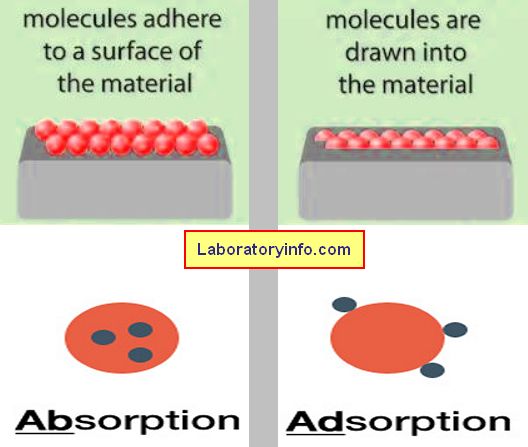
Se refiere a un evento químico o físico en el que el átomo, ion o molécula de la sustancia se une a otra sustancia.
Lectura relacionada: ¿Qué es la Prueba de la Ureasa ? Principio, Composición, Interpretación de los Resultados
¿Qué es la Prueba de la Ureasa ? Principio, Composición, Interpretación de los ResultadosEl absorbato es la sustancia que se absorbe, mientras que la sustancia que absorbe se denomina absorbente. Un ejemplo es una esponja y agua.
La esponja tiene la capacidad de absorber agua. En este escenario, la esponja es el absorbente y el absorbente es agua. Otros ejemplos de absorción son:
Lectura relacionada: Ensayo de Fenilalanina Desaminasa: Procedimiento, Principio y Usos
Ensayo de Fenilalanina Desaminasa: Procedimiento, Principio y Usos- Absorción de la piel
- Absorción intestinal
- Refrigeradores de absorción (1, 2, 3 y 4)
Qué es la adsorción?
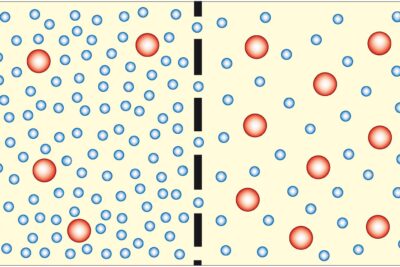
Es una ocurrencia en la que las moléculas de la sustancia se adhieren a la superficie de otra sustancia (líquido/sólido).
Adsorbato es el término usado para describir la sustancia que se adsorbe, mientras que adsorbente es la sustancia que se adsorbe.
Lectura relacionada: Prueba de Tolerancia a la Glucosa ( GTT): Principio, Procedimiento, Indicaciones e Interpretación
Prueba de Tolerancia a la Glucosa ( GTT): Principio, Procedimiento, Indicaciones e InterpretaciónLa interfaz se refiere a la superficie donde ocurre todo el proceso. La adsorción puede ser física o química. Ejemplos de adsorción son:
- Adsorción de proteínas sobre biomateriales.
- Oclusión de gas hidrógeno sobre paladio.
- Paquetes de gel de sílice en zapatos nuevos.
- Carbón activado en máscaras antigás. (2, 3, 4 y 5)
La tabla a continuación muestra las diferencias breves pero detalladas entre absorción y adsorción.
| Punto de referencia | Absorción | Adsorción |
|---|---|---|
| Significado / definición | La absorción consiste en llevar sustancias a la superficie con la ayuda de la ósmosis o la difusión. (3, 4) | La adsorción tiene que ver con la adhesión. Las moléculas de la sustancia se adhieren a la superficie de otras sustancias. |
| Componente | Hay dos componentes: absorbente y absorbente. | Hay dos componentes: adsorbato y adsorbente. (5) |
| Principio | El proceso de absorción se hace posible debido al espacio disponible en la sustancia, así como a la naturaleza de la partícula. (6, 7) | El proceso de adsorción es posible debido al espacio vacío del adsorbente responsable de estimular la adhesión de partículas sobre los espacios disponibles. (7) |
| Tipo | Hay dos tipos: absorción física y química.
|
|
| Intercambio de calor | El intercambio de calor se basa en el proceso endotérmico; la energía proviene del exterior de la superficie y es solo el proceso de absorción que aumenta la energía del absorbente. (5, 8) | Utiliza un proceso exotérmico. La energía de la superficie disminuye gradualmente para conducir a una reducción de las fuerzas residuales de la superficie. (9, 10) |
| Vinculación | Los materiales absorbidos permanecen en el absorbente y no tendrán ninguna reacción química con el absorbente. (3, 5) | En el proceso de adsorción, los materiales adsorbidos permanecen unidos al adsorbente con la ayuda de enlaces covalentes o fuerzas de Van der Wall. (6, 8) |
| Tasa | El proceso tiene lugar a una velocidad uniforme. (8) | El proceso de adsorción aumenta constantemente hasta que alcanza el equilibrio |
| Temperatura | El proceso no depende de la temperatura. | Tal proceso depende de la temperatura. |
| Concentracion | Después del proceso de absorción, la concentración de absorbato y absorbente permanece igual. | La concentración no es la misma en el adsorbato y el adsorbente. El adsorbato está más concentrado en la superficie en comparación con la sección del adsorbente. |
| Separación | Puede separar los materiales absorbidos en función de sus interacciones químicas. | Para separar los materiales adsorbidos, debe pasar una nueva sustancia a través de la superficie del adsorbente. Sin embargo, este método reemplazará el material adsorbido previamente. (6, 9 y 10) |
| Usos / aplicaciones |
|
|
| Fenómeno | Fenómeno a granel | Fenómeno de superficie |
| Ejemplos |
|
|
Resumen de las principales diferencias entre absorción y adsorción.
- Si bien la adsorción y la absorción suenan similares a menudo se usan indistintamente, debe recordar que son procesos diferentes.
- La absorción es cuando una sustancia es absorbida o absorbida a granel por otra sustancia, mientras que la adsorción es un fenómeno superficial en el que una sustancia particular se adhiere a la superficie de otra sustancia.
- La absorción tiene una velocidad de reacción uniforme y un proceso endotérmico, mientras que la adsorción tiene una velocidad de reacción constante hasta el memento en que alcanza el equilibrio. El proceso de adsorción es exotérmico. Cuando se trata de concentración, la concentración de la sustancia absorbida no cambia. Sigue siendo el mismo en todo el medio.
- Sin embargo, en la adsorción, la concentración de la sustancia adsorbida cambia. En cuanto a la temperatura, el proceso de absorción no se ve afectado. Sin embargo, la adsorción funciona bien a baja temperatura.
- Cuando se trata de industrias en las que la absorción juega un papel importante, incluyen el enfriamiento de la entrada de la turbina, la producción de hielo, el almacenamiento en frío y los refrigerantes. La adsorción es útil en purificación de agua, aire acondicionado, enfriadores y resina sintética, por nombrar algunos.
Por lo tanto, la próxima vez que vaya a utilizar la absorción y la adsorción, debe tener mucho cuidado de no intercambiarlas. Son homófonos pero son totalmente diferentes en significado y aplicación.
Ambos tienen papeles importantes que desempeñar en diversas industrias a las que están acostumbrados. Las diferencias descritas en la tabla solo demuestran que incluso dos palabras muy similares pueden tener grandes diferencias. (3, 6 y 10)