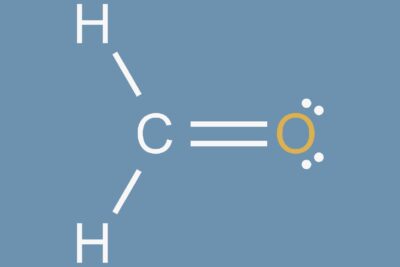
La fórmula molecular es una expresión del número y tipo de átomos que están presentes en una sola molécula de una sustancia. Representa la fórmula real de una molécula. Los subíndices después de los símbolos de los elementos representan el número de átomos. Si no hay subíndice, significa que un átomo está presente en el compuesto.
La fórmula empírica también se conoce como la fórmula más simple. La fórmula empírica es la relación de elementos presentes en el compuesto. Los subíndices en la fórmula son los números de átomos, lo que lleva a una relación de números enteros entre ellos.
Lectura relacionada:
 Introducción a la Tabla Periódica de los Elementos
Introducción a la Tabla Periódica de los ElementosEjemplos de Fórmulas Moleculares y Empíricas
La fórmula molecular de la glucosa es C6H12O6. Una molécula de glucosa contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
Si puedes dividir todos los números en una fórmula molecular por algún valor para simplificarlos aún más, entonces la fórmula empírica o simple será diferente de la fórmula molecular. La fórmula empírica para la glucosa es CH2O. La glucosa tiene 2 moles de hidrógeno por cada mol de carbono y oxígeno. Las fórmulas para el agua y el peróxido de hidrógeno son:
En el caso del agua, la fórmula molecular y la fórmula empírica son las mismas.
Lectura relacionada: ¿Qué es un Átomo?
¿Qué es un Átomo?
Encontrar la Fórmula Empírica y Molecular a partir de la Composición Porcentual
Porcentaje ( % ) de composición = (masa del elemento / masa del compuesto) X 100
Si se le da la composición porcentual de un compuesto, estos son los pasos para encontrar la fórmula empírica:
Lectura relacionada: Definición de Isótopos y Ejemplos en Química
Definición de Isótopos y Ejemplos en Química- Suponga que tiene una muestra de 100 gramos. Esto simplifica el cálculo porque los porcentajes serán los mismos que el número de gramos. Por ejemplo, si el 40% de la masa de un compuesto es oxígeno, entonces calcula que tiene 40 gramos de oxígeno.
- Convierte gramos a moles. La fórmula empírica es una comparación del número de moles de un compuesto, por lo que necesita sus valores en moles. Usando el ejemplo de oxígeno de nuevo, hay 16,0 gramos por mol de oxígeno, por lo que 40 gramos de oxígeno serían 40/16 = 2,5 moles de oxígeno.
- Compara el número de moles de cada elemento con el número más pequeño de moles que obtengas y divídelo por el número más pequeño.
- Redondea la proporción de moles al número entero más cercano, siempre que esté cerca de un número entero. En otras palabras, puede redondear 1.992 hasta 2, pero no puede redondear 1.33 a 1. Deberá reconocer las proporciones comunes, como 1.333 que es 4/3. Para algunos compuestos, el número más bajo de átomos de un elemento podría no ser 1. Si el número más bajo de moles es cuatro tercios, tendrás que multiplicar todas las proporciones por 3 para deshacerte de la fracción.
- Escribe la fórmula empírica del compuesto. Los números de razón son subíndices para los elementos.
Encontrar la fórmula molecular solo es posible si se le da la masa molar del compuesto. Cuando tienes la masa molar, puedes encontrar la relación entre la masa real del compuesto y la masa empírica. Si la relación es uno (como con el agua, H2O), entonces la fórmula empírica y la fórmula molecular son iguales. Si la relación es 2 (como con peróxido de hidrógeno, H2O2), luego multiplique los subíndices de la fórmula empírica por 2 para obtener la fórmula molecular correcta. dos.